
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
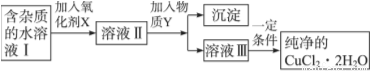
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
(1) 最适合作氧化剂X的是__________,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________。
(3)加入的物质Y是___(写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同 时还产生的现象有_______。
时还产生的现象有_______。
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:2016届辽宁抚顺第一中学高三上第一次模拟考试化学试卷(解析版) 题型:选择题
某可逆反应的△H=+146kJ/mol,下列关于该反应的叙述正确的是
A.正反应的活化能比逆反应的活化能大146kJ/mol
B.正反应的活化能一定小于146kJ/mol
C.逆反应的活化能一定大于146kJ/mol
D.逆反应的活化能一定大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附中高一上期中化学卷(解析版) 题型:选择题
标准状况下将VLHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=36.5c/(1000w) B.c=1000Vρ/(36.5V+22400)
C.V=22400w/[36.5(1-w)] D.ρ=(36.5V+22400)c/V
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三文化学卷(解析版) 题型:选择题
下列物质,不属于电解质的是( )
A、 NaOH B、H2SO4 C、蔗糖 D、氯化钠
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三理化学卷(解析版) 题型:选择题
一滴水约为0.05ml,设室温下水的密度为1g/cm3,则1滴水含水分子数是( )
A.3×1022个 B.1.7×1021个 C.2×1020个 D.3×1021个
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:填空题
在体积一定的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下SO2的转化反应的2SO2(g)+O2 (g) 2SO3(g)平衡常数K =532.4.
2SO3(g)平衡常数K =532.4.
下面三个混合体系中各物质的浓度如下表:
体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
(1) | 0.0600 | 0.400 | 2.000 | 不填 |
(2) | 0.0960 | 0.300 | 0.500 | 不填 |
(3) | 0.0862 | 0.263 | 1.020 | 不填 |
试判断各体系反应进行的方向:
体系(2) ;体系(3): (填正向、逆向或已平衡)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(文)化学试卷(解析版) 题型:填空题
(1)了解用药常识,有利于自我保健。现有下列药物:
A、阿司匹林 B、青霉素 C、抗酸药 D、麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是 。
②治疗胃酸过多,但患有严重的胃溃疡,应该选择 。
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是 。
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是
(2)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是 (填字母)。A.CO2 B.N2 C.NO2
②工业废水需处理达标后才能排放。
下列废水处理的方法合理的是 (填字母)。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中测试化学试卷(解析版) 题型:选择题
将NO2和NH3混合,在一定条件下发生反应: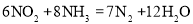 ,下列说法正确的是
,下列说法正确的是
A.NO2被氧化 B.NO2既是氧化剂,又是还原剂
C.NO2是氧化剂 D.1 mol NH3反应,转移3mol电子
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江大庆实验中学高三上学期期中考试化学试卷(解析版) 题型:实验题
氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。
Ⅰ.实验室模拟工业氨催化氧化法制取硝酸,装置如下图所示。

(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有烧杯、玻璃棒、量筒、 、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的化学式为 。
(3)写出受热时丙装置发生反应的化学方程式 。当戊中观察到石蕊试液变红,则说明已制得硝酸。
Ⅱ.NH3的性质
(4)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),将等浓度、等体积的氨水和硝酸混合,所得溶液中离子浓度从大到小的顺序为 。
(5)已知:氨在纯氧中燃烧生成一种单质和水,利用此原理设计成氨气-氧气燃料电池。在碱性条件下,该电池的负极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com