
| A、2.8g | B、4.4g |
| C、10.6g | D、1.4g |
| ||
| ||
| v |
| vm |
| 2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、碳酸钠常用于治疗胃溃疡病人的胃酸过多症 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、电解氯化镁溶液可获得金属镁 |
| D、铝土矿中提取铝的过程中不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应一定是放热反应 |
| B、该反应一定是吸热反应 |
| C、该反应中反应物的总能量一定小于产物的总能量 |
| D、该反应需要加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
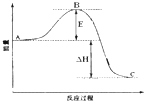 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )| A、图中A、C分别表示反应物总能量和生成物总能量 | ||
| B、加入催化剂,图中E和△H都减小 | ||
| C、图中△H=-99kJ?mol-1 | ||
D、SO3(g)?
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol和0.90mol之间 |
| D、等于0.90mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA |
| B、7 g CnH2n中含有的氢原子数目为NA |
| C、18 g D2O中含有的质子数目为10 NA |
| D、1 L 0.5 mol?L-1Na2CO3溶液中含有的CO32-数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C、氯化铁溶液与铁反应:2Fe3++Fe=3Fe2+ |
| D、碳酸钙中滴加盐酸:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
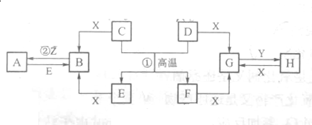 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com