


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:不详 题型:单选题
| A.1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 |
| B.1 mol SO2(g)的能量总和小于1 mol S(s)和1 mol O2(g)的能量总和 |
| C.S(g) + O2(g) = SO2(g)△H =" -Q" kJ·mol-1;Q的值大于297.23 |
| D.S(g) + O2(g)= SO2(g)△H =" -Q" kJ·mol-1;Q的值等于297.23 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2 O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
O2(g)===H2O(g) △H ="-241.8" kJ·mol-1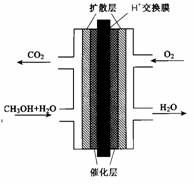
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K 2NH3(g)的K′=0.5。
2NH3(g)的K′=0.5。 N2(g)+3H2(g)的K=__________(填数值)。
N2(g)+3H2(g)的K=__________(填数值)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学键 | H—H | Cl—Cl | Cl—H |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
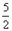 O2=2CO2(g)+H2O(l) △H=-1300kJ/mol的说法中,正确的是( )
O2=2CO2(g)+H2O(l) △H=-1300kJ/mol的说法中,正确的是( )| A.有10NA个电子转移时,该反应放出1300kJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-44.2kJ·mol-1 | B.+44.2kJ·mol-1 | C.-330kJ·mol-1 | D.+330kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com