
| A. | H2S和NH3均是价电子总数为8的极性分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CH2Cl2和CCl4均是四面体构型的非极性分子 | |
| D. | SO2和SO3来化轨道类型均为sp2杂化,空间构型分别为V形、平面三角形 |
分析 A.根据核外电子排布判断价电子总数;根据原子价层电子对个数=σ键个数+孤电子对个数判断分子空间构型,分子结构对称,正负电荷重心重合的分子为非极性分子,反之为极性分子;
B.同种元素原子间形成的共价键是非极性共价键,不同种元素原子之间形成的共价键是极性共价键;根据核外电子排布判断粒子电子数;
C.CH2Cl2和CCl4均是四面体构型,但CH2Cl2为极性分子;
D.根据价层电子对互斥理论确定原子杂化和分子空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:A.S、N、H原子核外最外层电子数分别为6、5、1,则H2S和NH3价电子总数均是8,NH3分子中心N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,分子结构不对称,为极性分子,H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构,分子结构不对称,为极性分子,故A正确;
B.HS-中只含有H-S极性键,HCl只含H-Cl极性键,H、S、Cl核外电子数分别为1、16、17,HS-和HCl都具有18个电子,故B正确;
C.CCl4含有C-Cl极性键,空间构型为正四面体型,结构对称且正负电荷的中心重合,为非极性分子,CH2Cl2是四面体构型,但不是正四面体型,结构不对称,为极性分子,故C错误;
D.三角锥形SO2中S原子价层电子对个数是3且含有一个孤电子对,所以S原子采用sp2杂化,该分子为V形结构,三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,所以硫原子采用sp2杂化,为平面三角形,故D正确;
故选C.
点评 本题考查分子的空间构型、分子的极性、粒子电子数等知识,注意价层电子对互斥理论熟练应用,注意极性分子的判断,题目难度不大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.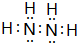 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y<X | |
| B. | 最简单气态氢化物的稳定性:HmY>HnX | |
| C. | 最高价含氧酸的酸性:元素X对应酸的酸性强于Y | |
| D. | X和Y形成的化合物中,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{23}^{51}$V和${\;}_{23}^{50}$V互为同位素 | |
| B. | ${\;}_{23}^{51}$和${\;}_{23}^{50}$V的质量数相同 | |
| C. | ${\;}_{23}^{51}$V和${\;}_{23}^{50}$V是同一种核素 | |
| D. | ${\;}_{23}^{51}$V和${\;}_{23}^{50}$V的核外电子数与中子数均为23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3↑+H2O | |
| B. | 氟气通入水中:2F2+2H2O═4H++4F-+O2 | |
| C. | AlCl3溶液中通入过量的氨气:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| D. | 将少量铜屑放入浓硝酸中:Cu+4 H++2NO3-═Cu2++2 NO2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 钠和钾的合金能导电 | 原子反应堆的导热剂 |
| B | 二氧化硫具有漂白性 | 漂白纸浆 |
| C | 镁燃饶时发出耀眼的强光 | 制作照明灯 |
| D | Al(OH)3加热易分解 | 塑料的阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在容积为 1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:CO(g)+2H2(g) CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
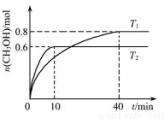
A.T1>T2
B.K(T1)>K(T2)
C. T1温度下达到平衡后,再充入一定量CO,CO的转化率增大
T1温度下达到平衡后,再充入一定量CO,CO的转化率增大
D.T2温度下,0~10min间v(H2)=0.06mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化 
 B.三角形 sp2杂化
B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com