
| A、标准状况下2.24 L三氯甲烷含有分子数目为0.1 NA |
| B、1mol18O2、16O3混合气体中定含有40NA个质子 |
| C、常温下,100 mL 1 mol?L-1的Na2CO3溶液中的阴离子数目大于0.1NA |
| D、3.2 g硫与铜充分反应,电子转移总数为0.1NA |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3?H2O)增大 |
| D、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.1mol的镁铝混合物溶于100mL 1.5mol?L-1的H2SO4中,然后再滴加1mol?L-1的NaOH溶液.请回答:
将0.1mol的镁铝混合物溶于100mL 1.5mol?L-1的H2SO4中,然后再滴加1mol?L-1的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
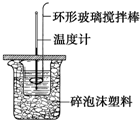 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色Cu(OH)2(s)+S2-?CuS(s)+2OH- |
| B、在H2O2溶液中,滴加FeC13溶液产生气泡:2H2O2+2C1-=2H2O+O2↑+C12↑ |
| C、将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生:Cu+2H+=Cu2++H2↑ |
| D、在CH3COONa溶液中,滴加酚酞变红:CH3COO-+H2O=CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应:Fe+2H+=Fe3++H2↑ |
| B、钠与冷水反应:Na+2H2O=Na++2OH-+H2↑ |
| C、醋酸与大理石反应:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O |
D、二氧化碳与苯酚钠溶液反应: +H2O+CO2→ +H2O+CO2→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)<c(Na+) |
| B、c(CH3COOH)+c(CH3COO-)=0.02mol/L |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(OH-)+c(CH3COO-)═c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与电源正极相连接的是电解槽的阳极 |
| B、与电源负极相连接的是电解槽的阴极 |
| C、电流从电源的负极沿导线流人电解槽的阴极 |
| D、在电解槽的阳极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com