
 硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:
硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:分析 (1)二氧化硫具有还原性,通入溴水中发生氧化还原反应,二氧化硫被氧化为硫酸;
(2)在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大;
(3)Hg2+(ap)+FeS(s)?Fe2+(ap)+HgS(s),反应的平衡常数K=$\frac{c(F{e}^{2+})}{c(H{g}^{2+})}$=$\frac{c(F{e}^{2+})}{c(H{g}^{2+})}$×$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(FeS)}{Ksp(HgS)}$计算得到;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
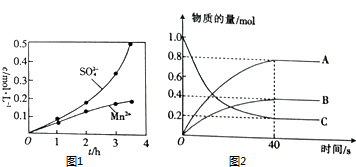
(5)在10L恒容器闭容器中H2S分解生成氢气和S2,图象分析可知C为H2S,AB为生成物,40s(1mol-0.2mol)=0.8molH2S分解生成A0.8mol,生成B为0.4mol,反应比为2:2:1,反应的化学方程式为:2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,
①分析可知A为生成氢气的变化曲线;
②反应速率v=$\frac{△c}{△t}$;
③依据化学反应三行计算列式计算,转化率=$\frac{消耗量}{起始量}$×100%,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$.
解答 解:(1)SO2可用于海水提溴.在SO2吸收溴蒸气的反应中,发生氧化还原反应为:SO2+Br2+2H2O=2HBr+H2SO4,二氧化硫中硫元素化合价+价变化为+6价,二氧化硫做还原性被已化为硫酸,氧化产物为H2SO4,故答案为:H2SO4;
(2)SO2水溶液可用于浸取低品位的软锰矿,发生的反应为MnO2+H2SO3=MnSO4+H2O.浸取过程中反应器内c(Mn2+)、c(SO42-)随时间的变化图象分析可知.难度增大,导致反应速率不断加快,$\frac{c(S{{O}_{4}}^{2-})}{c(M{n}^{2+})}$比值增大,是因为生成的Mn2+对反应2H2SO3+O2=2H2SO4,起到催化剂的作用加快反应速率,在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大,
故答案为:生成的Mn2+对反应2H2SO3+O2=2H2SO4,起到催化剂的作用加快反应速率;
(3)Hg2+(ap)+FeS(s)?Fe2+(ap)+HgS(s),反应的平衡常数K=$\frac{c(F{e}^{2+})}{c(H{g}^{2+})}$=$\frac{c(F{e}^{2+})}{c(H{g}^{2+})}$×$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(FeS)}{Ksp(HgS)}$=$\frac{6.0×1{0}^{-18}}{4.0×1{0}^{-53}}$=1.5×1035,
故答案为:1.5×1035 ;
(4)①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)△H=-1040.2kJ•mol-1
②4H2S(g)+2SO2(g)?3S2(g)+4H2O(g)△H=+89.8kJ•mol-1
依据盖斯定律计算(①+②)×$\frac{1}{3}$得到热化学方程式:2H2S(g)+O2(g)=S2(g)+2H2O(g)△H=-316.8KJ/mol,
故答案为:316.8;
(5)在10L恒容器闭容器中H2S分解生成氢气和S2,图象分析可知C为H2S,AB为生成物,40s(1mol-0.2mol)=0.8molH2S分解生成A0.8mol,生成B为0.4mol,反应比为2:2:1,反应的化学方程式为:2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,
①分析可知A为生成氢气的变化曲线,H2S分解制H2和S2反应的化学方程式为:2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,
故答案为:A;2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2;
②0~40s内,v(H2S)=$\frac{△c}{△t}$=$\frac{\frac{1.0mol-0.2mol}{10L}}{40s}$=0.002mol/(L•s),
故答案为:0.002mol/(L•s);
③依据化学反应三行计算列式计算,
2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,
起始量(mol/L) 0.1 0 0
变化量(mol/L) 0.08 0.08 0.04
平衡量(mol/L) 0.02 0.08 0.04
H2S转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.08mol/L}{0.1mol/L}$=80%,
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.04×0.0{8}^{2}}{0.0{2}^{2}}$=0.64,
故答案为:80%;0.64.
点评 本题考查了氧化还原反应,热化学方程式和盖斯定律的计算应用,化学反应速率、平衡常数和转化率的概念计算等知识点,掌握基础是解题关键,题目难度中等.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
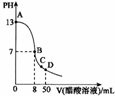 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A. | 曲线上任一点:c(Na+)+c(H+)=c(0H-)+c(CH3C00H) | |
| B. | 在 B点,a=25,且有 c(Na+)=c(CH3C00-)>c(0H-)=c(H+) | |
| C. | 在C点:c(Na+)>c(CH3C00-)>c(H+)>c(0H-) | |
| D. | 在D点:c(CH3C00-)+c(CH3C00H)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中0族元素的单质全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大 | |
| D. | 所有主族元素的原子形成单核离子时的价数都和它的族数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | A、L、M三元素的金属性逐渐增强 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | A在T单质中燃烧所形成的化合物中含有共价键和离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为: 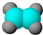 ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为: 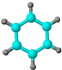 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: 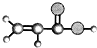 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com