
| A. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中微粒间可能存在氢键 | |
| D. | C3N4晶体是分子晶体 |
分析 C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合,则为原子晶体,每个C原子周围有4个N原子,每个N原子周围有3个C原子,形成空间网状结构,C-N键为共价键,比C-C键短,据此分析.
解答 解:A.原子间均以单键结合,则C3N4晶体中每个C原子形成4个共价键,即连接4个N原子,而每个N原子形成3个共价键,即连接3个C原子,故A正确;
B.因N的原子半径比C原子半径小,则C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要短,故B错误;
C.C3N4晶体中构成微粒为原子,微粒间通过共价键合,不存在氢键,故C错误;
D.C3N4晶体具有比金刚石更大的硬度,则C3N4晶体是原子晶体,故D错误;
故选A.
点评 本题考查原子晶体的性质及作用力,明确信息是解答本题的关键,熟悉原子晶体的构成微粒、作用力、空间结构即可解答,题目难度不大,注重知识的迁移能力来分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有7个横行即7个周期,有18个纵行,共16个族 | |
| B. | 在周期表的右上角可找到耐高温、耐腐蚀的材料 | |
| C. | 因为等浓度的HI和HCl的酸性:HI>HCl,所以非金属性:I>Cl | |
| D. | 在周期表中与IIA相邻的是IA和IIIA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子里碳氢原子个数比为1:2 | |
| B. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol乙烯完全加成消耗1mol溴单质 | |
| D. | 乙烯完全燃烧生成的CO2和H2O的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | SO2通入溴水中:SO2+Br2+2H2O═SO42-+2Br-+4H+ | |
| C. | Fe(OH)2溶于过量的稀HNO3:Fe(OH)2+2H+═2Fe2++2H2O | |
| D. | 少量氯水滴入FeBr2溶液中:Cl2+2Br-═2C1-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
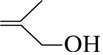 的分子式为C2H8O.
的分子式为C2H8O. 中官能团的名称羟基、羧基.
中官能团的名称羟基、羧基. .
. )为苯的同分异构体,M的二氯代物的同分异构体有3种.
)为苯的同分异构体,M的二氯代物的同分异构体有3种. )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由 (写结构简式)发生加聚反应生成的.
(写结构简式)发生加聚反应生成的. )与新制的氢氧化铜悬浊液共热的化学方程式:
)与新制的氢氧化铜悬浊液共热的化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题


 .设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
.设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com