
【题目】电镀废液中Cr2O7可通过下列反应转化成铬黄(PbCrO4):
Cr2O![]() (aq)+2Pb2+(aq)+H2O(l)
(aq)+2Pb2+(aq)+H2O(l) ![]() 2PbCrO4(s)+2H+(aq) ΔH<0
2PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 ( )。
A. 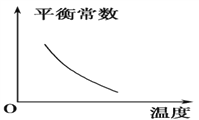 B.
B. 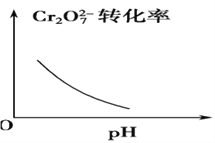
C.  D.
D. 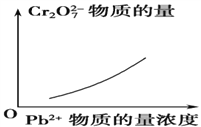
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】煤是重要的化工原料,用煤作燃料不仅浪费,而且因烟煤中含有硫的化合物(FeS2)燃烧时生成SO2气体造成环境污染。假设一个具有3万户人口的小型城市,平均每户燃煤5kg,这种煤含FeS25%,在燃烧时如有90%的S转化为SO2,并被排入大气中,试计算:
(1)该城市仅居民作燃料用煤一年(365天)向大气中排放SO2的总质量达多少吨?______
(2)假如这些SO2全部能回收,可生产98%的H2SO4多少吨?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知地球上元素原子各电子层最多能容纳的电子数为2n2(n表示电子层序数),若X星球上的元素原子各电子层最多能容纳的电子数为n(n+1),n表示电子层数,该星球上元素原子的电子排布的其他规则与地球相同,回答下列问题:
(1)X星球上的质子数为5的元素原子最外层电子数为___个;
(2)X星球上的质子数为9的元素原子的结构示意图为___,该元素属于___元素(填“金属”或“非金属”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/c(CO2)·c(H2)恒容时,温度升高,H2浓度减小.下列说法正确的是
A. 该反应的焓变为负值
B. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
C. 2CO2(g)+2H2(g)2CO(g)+2H2O(g) 的平衡常数K1=K2
D. 若恒容、恒温下充入CO,则K值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中,所发生的反应方程式为______________________________________。与电源_______极相连的电极附近溶液滴入酚酞显红色。阳极产物是______________,实验室用__________________________检验该物质。
(2)如果粗盐中SO42含量较高,必须添加钡试剂除去SO42,该试剂可以是_____________________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 d.BaCO3
(3)为有效除去Ca2+、Mg2+、SO42,加入试剂的合理顺序为__________________。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是 ( )
A. 乙酸乙酯和水,酒精和水,乙酸和水
B. 溴苯和水,甲苯和苯,醋酸和水
C. 汽油和水,乙酸和水,乙酸和乙醇
D. 乙酸乙酯和水,甲苯和水,苯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S燃料电池应用前景非常广阔,该电池示意图如下。下列说法正确的是( )
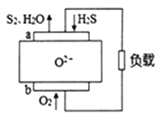
A. 电极a是正极 B. O2-由电极a移向电极b
C. 电极 a 的反应式为:2H2S+2O2--4e-=S2+2H2O D. 当通入1.12LO2,转移电子数0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO42H2O)的流程如下:

(1) Na2MoO42H2O中Mo元素的化合价为____;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为________。
(2)流程中由Na2MoO4溶液获得晶体的操作是_________、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为______________。
(3)操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是______。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,溶液体积变化可忽略]
(4)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是_____。
(5)高纯Mo可用于制造电池级MoS2,Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2![]() Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n,该电池放电时正极反应为______________;充电时Li+移动方向为________(填“由阳极移向阴极”或“由阴极移向阳极”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com