
| A、溶液的pH增大 |
| B、CH3COOH的电离程度增大 |
| C、溶液的导电能力减弱 |
| D、溶液的c(OH-)减小 |


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
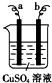
| A、该装置可以构成原电池,也可构成电解池 |
| B、a极可能发生反应:Cu2++2e-═Cu |
| C、b电极质量可能增加 |
| D、该过程可能有大量气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、SO42-、OH- |
| B、Na+、CO32-、Cl- |
| C、H+、SO42-、OH- |
| D、Ag+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中氧化剂是C12 |
| B、该反应是复分解反应 |
| C、反应中S元素的价态降低 |
| D、该反应中H2O被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 | ||||
B、0.1 mol?L-1氨水加水稀释后,溶液中
| ||||
| C、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||||
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、放电时,LixC6发生氧化反应 |
| B、充电时,Li+通过阳离子交换膜从左向右移动 |
| C、充电时将电池的负极与外接电源的负极相连 |
| D、放电时,电池的正极反应为Li1-xCoO2+xLi++xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com