
| A. | 加入无水CuSO4,再过滤 | |
| B. | 加入生石灰,再蒸馏 | |
| C. | 加入浓H2SO4,再加热,蒸出乙醇 | |
| D. | 将96%的乙醇溶液直接加热蒸馏出来 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:多选题
| A. | 原子半径A<B<C | B. | A的氢化物的稳定性大于C的氢化物 | ||
| C. | B的氧化物熔点比A的氧化物高 | D. | A与C可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:
如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:| A. | 可以观察到,硫在氧气中燃烧发出蓝紫色火焰 | |
| B. | 实验结束时,应用注射器向装置中注入NaOH溶液以便更充分地吸收剩余的SO2气体 | |
| C. | A装置中的注射器的作用相当于分液漏斗,可以随时控制反应的发生和停止 | |
| D. | “酸雨”使绿叶变黄,使锌粒、镁片表面产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③正确 | B. | ①②⑤正确 | C. | 都正确 | D. | ②③④⑤正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用15N可以测定亚硝酸盐对地下水质的污染情况.
利用15N可以测定亚硝酸盐对地下水质的污染情况. ,15N2的结构式为15N≡15N;
,15N2的结构式为15N≡15N;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
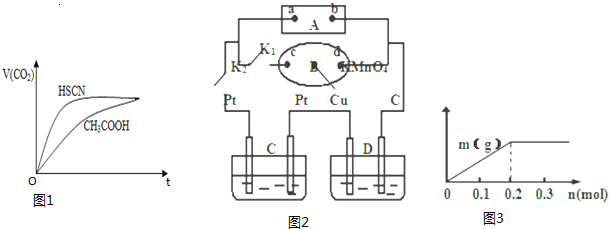
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度都为0.1mol•L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 | |
| C. | 向浓度都为0.1mol•L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 | |
| D. | 向0.1mol•L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com