
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
【答案】 ![]() 或
或![]() 2.0×10-3 k1=60k2 > > 恰好完全反应生成NaHN2O2,Kh(HN2O2-)=
2.0×10-3 k1=60k2 > > 恰好完全反应生成NaHN2O2,Kh(HN2O2-)=![]() >Ka2=10-12,水解程度大于电离程度,因此溶液中c(H2N2O2)>c(N2O22-) c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)
>Ka2=10-12,水解程度大于电离程度,因此溶液中c(H2N2O2)>c(N2O22-) c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)
【解析】试题分析:(1)根据盖斯定律书写用CO还原NO2至N2的热化学方程式,再根据热化学方程式计算消耗标准状况下3.36L CO时放出的热量;(2) ①根据![]() 计算v(N2O4); ②先计算达到平衡时NO2、N2O4的浓度,再根据平衡时v(NO2):v(N2O4)=2:1计算k1、k2的数学关系式;(3) ①若V=100,溶液中的溶质是NaHN2O2;②若V=200,溶液中的溶质是Na2N2O2;
计算v(N2O4); ②先计算达到平衡时NO2、N2O4的浓度,再根据平衡时v(NO2):v(N2O4)=2:1计算k1、k2的数学关系式;(3) ①若V=100,溶液中的溶质是NaHN2O2;②若V=200,溶液中的溶质是Na2N2O2;
解析:(1) ①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0);②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0);根据盖斯定律①![]() ②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=(-2a-b) kJ·mol-1,标准状况下3.36L CO的物质的量是0.15mol,消耗标准状况下3.36L CO时放出的热量
②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=(-2a-b) kJ·mol-1,标准状况下3.36L CO的物质的量是0.15mol,消耗标准状况下3.36L CO时放出的热量![]() kJ;(2) ①设 0~20 min内生成N2O4的物质的量是xmol,
kJ;(2) ①设 0~20 min内生成N2O4的物质的量是xmol,
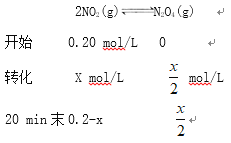
![]()
X=0.08mol,v(N2O4)= ![]() mol/L
mol/L ![]() = 2.0×10-3。
= 2.0×10-3。
②设平衡时N2O4的浓度x mol/L,
![]()
![]()
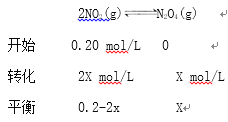
![]()
X=0.075 mol/L,v(NO2):v(N2O4)=2:1即k1·c2(NO2):k2·c(N2O4)=2:1,k1![]() 0.0025:k2
0.0025:k2![]() 0.075=2:1,所以k1=60k2。若改变温度至T1时k1=k2,则正反应速率小于逆反应速率,平衡逆向移动,该反应的正反应放热,所以T1>373K;(3) ①若V=100,溶液中的溶质是NaHN2O2,HN2O2-的电离平衡常数是10-12,水解平衡常数是
0.075=2:1,所以k1=60k2。若改变温度至T1时k1=k2,则正反应速率小于逆反应速率,平衡逆向移动,该反应的正反应放热,所以T1>373K;(3) ①若V=100,溶液中的溶质是NaHN2O2,HN2O2-的电离平衡常数是10-12,水解平衡常数是![]() ,水解大于电离,所以 c(H2N2O2)>c(N2O22-);②若V=200,溶液中的溶质是Na2N2O2,N2O22-发生两步水解反应,所以所得溶液中离子浓度由大到小的顺序为c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)。
,水解大于电离,所以 c(H2N2O2)>c(N2O22-);②若V=200,溶液中的溶质是Na2N2O2,N2O22-发生两步水解反应,所以所得溶液中离子浓度由大到小的顺序为c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】(1)CH、CH3、CH都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N叫做叠氮离子,请写出3种由三个原子构成的含有与N的电子数相同的粒子的化学式______、______、______。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
(5)PH3在常温下是一种无色、剧毒、易自燃的气体,分子结构和NH3相似。在常温下1体积的水能溶解0.26体积的PH3,PH3和卤化氢(HX)作用生成相应的化合物PH4X,PH4X在水溶液中完全水解(PH结构类似于CH4)。PH3的分子结构的形状是________;在PH中P-H键之间的夹角是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同主族的A、B两元素,已知A的原子序数为x,A和B所在周期包含元素的种数分别为m和n,如果A和B在第ⅠA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________;如果A和B在第ⅦA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________。
(2)已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是(____)
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3. 写出该反应方程式并配平,用单线桥标出电子转移方向与数目。____________________ ,该反应中,氧化剂是___________,被氧化的元素是___________,若产生标准状况下11.2L气体,转移电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
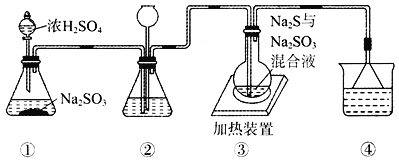
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Ag++Cl-===AgCl↓
②Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
④Fe+Cu2+===Fe2++Cu
A.①③ B.②④ C.②③ D.没有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁块,放置一段时间。下列有关描述正确的是
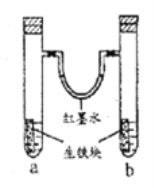
A. 生铁块中的碳是原电池的负极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe-2e-=Fe2+
D. a试管中发生了析氢腐蚀,b试管中发生了吸氧腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com