
分析 (1)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式;
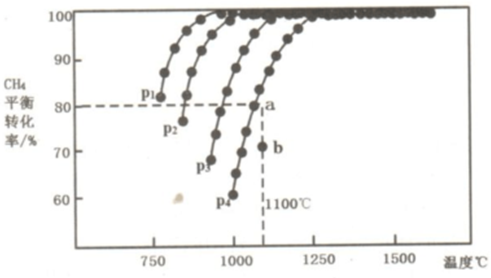
(2)①由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,据此判断;
②由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答,由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行;
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),平衡常数等于生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积得到,结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为80%,
CO2(g)+CH4(g)?2CO(g)+2H2(g),
起始量(mol) 1 1 0 0
变化量(mol)0.8 0.8 1.6 1.6
平衡量(mol)0.2 0.2 1.6 1.6
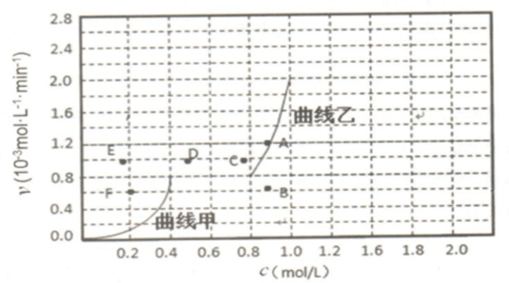
④ⅰ)甲烷是反应物随反应进行浓度减小,CO是生成物,浓度从0到0.8;
ii)反应是吸热反应,降温平衡逆向进行,CO逆反应速率减小,正反应速率减小,甲烷浓度增大,一氧化碳浓度减小.
解答 解:(1)根据盖斯定律,将已知反应[①-②-③×4]÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=[(-1274.0kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4]÷2=442kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ•mol-1;
(2)①由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,故正反应为吸热反应,即△H>0,
故答案为:>;
②由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,故在Y点:v(正)>v(逆),
故答案为:p4>p3>p2>p1;>;
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=$\frac{{P}^{2}(CO){P}^{2}({H}_{2})}{P(C{O}_{2})P(C{H}_{4})}$,
结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为80%,
CO2(g)+CH4(g)?2CO(g)+2H2(g),
起始量(mol) 1 1 0 0
变化量(mol)0.8 0.8 1.6 1.6
平衡量(mol)0.2 0.2 1.6 1.6
平衡气体总物质的量=3.6mol,如果P4=0.36MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,求a点的平衡常数Kp=$\frac{(0.36×\frac{1.6}{3.6})^{2}×(0.36×\frac{1.6}{3.6})^{2}}{0.36×\frac{1.6}{3.6}×0.36×\frac{1.6}{3.6}}$=1.64(MPa)2,
故答案为:$\frac{{P}^{2}(CO){P}^{2}({H}_{2})}{P(C{O}_{2})P(C{H}_{4})}$;1.64(MPa)2;
④i)甲烷是反应物随反应进行浓度减小,CO是生成物,浓度从0到0.8,所以与曲线v正~c(CH4)相对应的是上图中曲线是乙,
故答案为:乙;
ii)反应是吸热反应,降温平衡逆向进行,CO逆反应速率减小,正反应速率减小,甲烷浓度增大,一氧化碳浓度减小,反应重新达到平衡,相应的平衡点分别为BF,
故答案为:B F.
点评 本题考查化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,注意利用“定一议二”原则分析解答.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | A的式量比B大14 | |
| B. | B的式量比A大16 | |
| C. | 该酯中一定不含双键等不饱和键 | |
| D. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、NH3、CH4 | B. | H2SO4、HNO3、BaCl2 | ||
| C. | CO2、NH3、Cu | D. | KNO3、NaOH、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下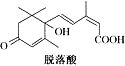 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )| A. | 其分子式为C15H22O4 | |
| B. | 其属于芳香族化合物 | |
| C. | 能与氢氧化钠溶液反应,但不能与碳酸氢钠溶液反应 | |
| D. | 该物质在一定条件下可发生自身取代反应生成含七元环的物质. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
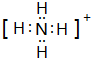 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为$\frac{4}{15}$NA | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、CO、CO2均为酸性氧化物 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2的质子数相同,互为同位素 | |
| C. | 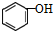 与 与 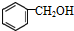 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和蛋白质都属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com