
 ,C中官能团的名称是醛基;
,C中官能团的名称是醛基; ;
; ;
;
分析 A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2,说明A比苯多-CH2CH2原子团,A的核磁共振氢谱有3组峰,则A为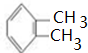 ;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为
;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为 ,C为
,C为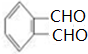 ;
;
X和B是同分异构体,则X为 ,X发生水解反应然后酸化得到D,D为
,X发生水解反应然后酸化得到D,D为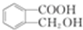 ,D发生缩聚反应生成高分子化合物的酯,为
,D发生缩聚反应生成高分子化合物的酯,为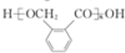 ;
;
(5)G是酯类增塑剂,应该是高分子酯类化合物,则H和F发生酯化反应生成G,H、F一个是羧酸、一个是醇,乙烯和水反应生成乙醇,若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则H为羧酸,所以H为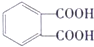 ,F为CH3CH2OH,G为
,F为CH3CH2OH,G为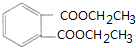 .
.
解答 解:A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2,说明A比苯多-CH2CH2原子团,A的核磁共振氢谱有3组峰,则A为 ;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为
;A和氯气在光照条件下发生取代反应生成B、X,B与X互为同分异构体,1molC发生银镜反应时最多可得到4molAg,说明一个C分子中含有两个醛基,B发生水解反应生成C,则B为 ,C为
,C为 ;
;
X和B是同分异构体,则X为 ,X发生水解反应然后酸化得到D,D为
,X发生水解反应然后酸化得到D,D为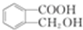 ,D发生缩聚反应生成高分子化合物的酯,为
,D发生缩聚反应生成高分子化合物的酯,为 ;
;
(5)G是酯类增塑剂,应该是高分子酯类化合物,则H和F发生酯化反应生成G,H、F一个是羧酸、一个是醇,乙烯和水反应生成乙醇,若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则H为羧酸,所以H为 ,F为CH3CH2OH,G为
,F为CH3CH2OH,G为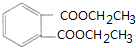 ,
,
(1)A为 ,A的名称是邻二甲苯或1,2-二甲苯,B为
,A的名称是邻二甲苯或1,2-二甲苯,B为 ,B水解生成的HCl和氢氧化钠反应,所以1molB最多消耗4mol NaOH,
,B水解生成的HCl和氢氧化钠反应,所以1molB最多消耗4mol NaOH,
故答案为:邻二甲苯或1,2-二甲苯;4;
(2)X的结构简式为 ,C中官能团的名称是醛基,
,C中官能团的名称是醛基,
故答案为: ;醛基;
;醛基;
(3)D发生缩聚反应生成E,该反应的化学方程式为 ,
,
故答案为: ;
;
(4)D为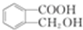 ,D的同分异构体符合下列条件,①能与浓溴水发生取代反应说明含有酚羟基;②能发生水解反应说明含有酯基,
,D的同分异构体符合下列条件,①能与浓溴水发生取代反应说明含有酚羟基;②能发生水解反应说明含有酯基,
如果含有酯基和酚羟基,为含有酚羟基的苯甲酸甲酯,有邻间对三种结构;
如果为含有酚羟基的甲酸苯甲酯,有邻间对3种结构;
如果为含有酚羟基的乙酸苯酯,有邻间对3种结构;
如果含有-OH、酯基和甲基,
如果酯基和-OH处于邻位,有4种结构;
如果酯基和-OH位于间位,有4种结构;
如果酯基和-OH位于对位,有2种结合,
所以符合条件的有19种结构;
其中核磁共振氢谱有5组峰的结构简式为 ;
;
故答案为:19; ;
;
(5)G是酯类增塑剂,应该是高分子酯类化合物,则H和F发生酯化反应生成G,H、F一个是羧酸、一个是醇,乙烯和水反应生成乙醇,若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则H为羧酸,所以H为 ,F为CH3CH2OH,G为
,F为CH3CH2OH,G为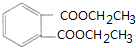 ,
,
①试剂I是水,故答案为:水;
②工业上发生I的反应是醛基被氧化生成羧基,所以该反应的试剂与条件是氧气、催化剂和加热,
故答案为:氧气、催化剂和加热;
③G为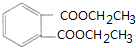 ,则G的分子式为C12H14O4,
,则G的分子式为C12H14O4,
故答案为:C12H14O4.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确判断A结构简式是解本题关键,结合反应条件分析推断,难点是(4)中同分异构体种类判断,要考虑位置异构、取代基异构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2900kJ | B. | 2680kJ | C. | 3120kJ | D. | 2856kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
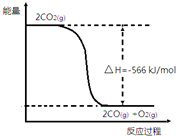 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 实验室点燃H2前,应先检验气体纯度 | |
| C. | 氯水与亚硫酸钠溶液的混合液,漂白性更强 | |
| D. | 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题:
铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、SO42- | B. | Na+、Fe3+、NO3-、SCN- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | Fe2+、H+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com