
【题目】氯气的制取及其性质的微型实验: ①用滤纸剪成四个适当大小的长方形,然后将这些滤纸都用凡士林粘在集气瓶内部。
②将饱和NaI、NaBr、Na2S、品红溶液(1~2滴)滴在如图所示的滤纸上。
③向集气瓶内加1.5 g KClO3 , 用滴管吸取约2 mL浓盐酸,然后将滴管装在双孔塞上,最后把该双孔塞塞在集气瓶上,如图所示。
④用滴管向漏斗中加NaOH溶液,注意所加NaOH溶液应以刚好装满漏斗下端的弯管处为宜(NaOH溶液在此起液封作用同时又有减压功能)
⑤挤压胶头滴管向集气瓶中加浓盐酸。
⑥整个现象看完后,用滴管向漏斗中加NaOH溶液吸收尾气。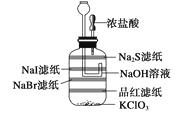
(1)该实验的主要现象: ;
(2)该实验的化学方程式:。
【答案】
(1)有黄绿色的气体产生,滴品红的滤纸红色褪去;滴NaBr的滤纸变为棕黄色;滴Na2S的滤纸有黄色出现;滴NaI的滤纸出现紫黑色
(2)①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O ②Na2S+Cl2===S↓+2NaCl
③2NaBr+Cl2===2NaCl+Br2
④2NaI+Cl2===2NaCl+I2
【解析】(1)主要现象:有黄绿色的气体产生,滴品红的滤纸红色褪去;滴NaBr的滤纸变为 棕红色;滴Na2S的滤纸有黄色出现;滴NaI的滤纸出现紫黑色。 (2)化学方程式:①KClO3+6HCl(浓)==KCl+3Cl2↑+3H2O ②Na2S+Cl2==S↓+2NaCl ③2NaBr+Cl2==2NaCl+Br2 ④2NaI+Cl2==2NaCl+I2 (1)该实验装置可以拿起走,所有的学生都能清楚地看见实验现象。 (2)不排放毒气,非常环保。 (3)药品消耗量少,操作简单,非常适宜学生实验
【考点精析】本题主要考查了氯气的化学性质的相关知识点,需要掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.模拟处理装置如图所示,下列说法错误的是( ) 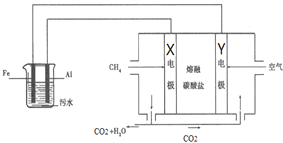
A.X电极是负极,电极反应式为:CH4-8e-+4CO32-═5CO2+2H2O
B.铁是阳极,失去电子生成Fe2+
C.工作时熔融盐中的碳酸根移向Y电极
D.污水中存在反应:4Fe2++10H2O+O2═4Fe(OH)3↓+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置和操作,回答下列有关问题。 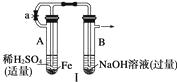
(1)按图Ⅰ所示装置,用两种不同的操作分别进行实验,观察B管中的现象。 ①操作1:先夹紧止水夹a,再使A管开始反应,实验中观察到B管中的现象是
。
②操作2:打开止水夹a,使A管反应一段时间后再夹紧止水夹a,实验中观察到B管
中的现象是。
③请说明造成两种操作现象不同的原因(如两种现象相同,此小题不用回答):
。
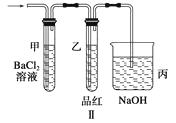
(2)上述装置实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后,再高温煅 烧(有关装置和操作均已略去),最后留下红色固体,将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
① 用方程式表示试管甲产生白色沉淀的原因。
②根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生的化学反应方程式
。
③图Ⅱ中丙装置的作用是。
实验结束时,在装置丙中观察到的现象是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一小块金属钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是( )
①变成白色粉末 ②变暗 ③变成白色固体 ④表面有液体生成 ⑤形成白色晶体
A.①②③④⑤B.②③④⑤①C.②⑤③①④D.③⑤②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的叙述中,正确的是
A.1mol任何物质都含有6.02×1023个分子B.0.012gC-12中约含有6.02×1023个碳原子
C.1mol水中含有2mol氢和1mol氧D.1molH2分子中含有2molH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。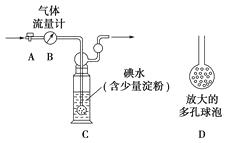
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是:。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种?
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量(填“偏高”、“偏低”或“无影响”)。
(4)写出步骤②中反应的化学方程式。
(5)步骤③中洗涤沉淀的方法是。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝矾石(主要成分是Al2O3 , 还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下: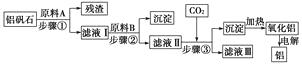
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,不正确的是( )
A.铝矾石中只含有金属氧化物
B.铝矾石与河沙含有相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中不涉及置换反应
(2)原料A的名称是 , 步骤①用到的主要玻璃仪器有。
(3)滤液Ⅰ中要加入稍过量的原料B,原料B的化学式是 , 步骤②反应的离子方程式为。
(4)在步骤③中(填“能”或“不能”)用盐酸代替CO2 , 原因是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com