
【题目】某同学利用如图所示装置探究金属的腐蚀与防护,下列有关说法错误的是

A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,用酒精灯加热具支试管,可以更快更清晰地观察到液柱上升
C. 图③,利用了外加电流的阴极保护法保护钢闸门不被腐蚀
D. 图④,利用了牺牲阳极的阴极保护法保护钢铁输水管不被腐蚀
【答案】B
【解析】
铁在潮湿的环境中易生锈;加热具支试管,具支试管内气体膨胀,小试管内产生气泡;外加电流阴极保护法是把被保护的金属连接在电源的负极上,这样就能消除被保护金属发生氧化反应;牺牲阳极保护法是在金属上连接比它更活泼的另一金属,构成原电池,活泼金属作负极被腐蚀而不活泼金属作正极受到保护。
铁在潮湿的环境中易生锈,放置于干燥空气中的铁钉不易生锈,故A正确;加热具支试管,具支试管内气体膨胀,小试管内产生气泡,观察不到液柱上升,故B错误;外加电流阴极保护法是把被保护的金属连接在电源的负极上,故C正确;牺牲阳极保护法是在金属上铆接比它更活泼的另一金属,构成原电池,活泼金属作负极被腐蚀而较不活泼金属受到保护,镁比铁活泼,所以镁失电子被腐蚀,钢铁输水管被保护,故D正确;选B。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】传统中药的砷剂俗称“砒霜”,请回答下列问题:
(1)砷剂的分子结构如图甲所示.该化合物中As原子的杂化方式为__.
(2)基态砷原子的价层电子排布式为__,砷与硒的第一电离能较大的是__.
(3)已知:

依据表中数据解释NH3熔点最高的原因__.
(4)砷酸(H3AsO4)是一种三元中强酸,根据价层电子对互斥理论推测AsO43﹣的空间构型为__.
(5)砷镍合金的晶胞如图乙所示,该晶体中与每个Ni原子距离最近的As原子有__个.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ksp(Ag2SO4)=2.0×10-5。取适量Ag2SO4溶于蒸馏水得到200 mL饱和溶液,在该饱和溶液中c(SO42-)=0.017 mol·L-1。向该饱和溶液中加入0.020 mol·L-1 Na2SO4溶液200 mL,得到溶液R。(不考虑混合后溶液体积的变化)下列说法正确的是( )
A.R中c(Ag+)=2c(SO42-)
B.得到溶液R的过程中会产生沉淀
C.R中c(Ag+)=0.017 mol·L-1
D.加入Na2SO4溶液促进沉淀溶解平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: __________________。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是________;下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
②25℃时, 等浓度的Na2CO3、CH3COONa 和NaClO三种溶液的pH从小到大依次是____________。
(3) 25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比, ___________ (填化学式)溶液中的c(Mg2+)大。
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中 c(CH3COO-)-c(Na+)=_________mol·L-1(填计算式,不用求具体值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中,一定能说明反应A(g)+3B(g)![]() 2C(g)+2D(g)达到平衡状态的是
2C(g)+2D(g)达到平衡状态的是
A.反应体系的总压恒定B.2v(B)正=3v(C)逆
C.c(A):c(B)=1:3D.单位时间内生成2molC,同时生成2molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用“Cu+2Ag+=2Ag+Cu2+”反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题:

(1)b极是电池的_____________极,材料是_____________,写出该电极的反应式_____________。
(2)a可以为_____________A、铜B、银C、铁D、石墨
(3)c溶液是_____________A、CuSO4溶液B、AgNO3溶液C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为_____________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是一种新型抗炎、解热、镇痛药,其结构如下所示。下列对该化合物叙述正确的是

A. 贝诺酯分子式为![]()
B. 贝诺酯属于芳香烃
C. 贝诺酯属于高分子化合物
D. 已知贝诺酯的水解产物之一为对氨基乙酰酚( ),在核磁共振氢谱中,对氨基乙酰酚有5种峰
),在核磁共振氢谱中,对氨基乙酰酚有5种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,a g甲气体和b g乙气体所占体积之比为1:1,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A.同温同压下,甲和乙的密度之比为a:b
B.甲与乙的相对分子质量之比为a:b
C.同温同压下,等体积的甲和乙的质量之比为a:b
D.等质量的甲和乙中的原子数之比一定为b:a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l L pH=l0的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是
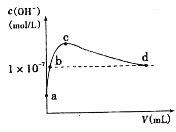
A. a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B. b点溶液中:c(H+)=1×10-7mol·L-1
C. c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D. d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com