
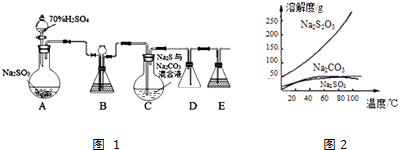
���� ����װ��ͼ��֪��A�е����������м���Ũ�������ɶ�������װ��B������֮һ�ǹ۲�SO2���������ʣ�Ϊ��߲�Ʒ���ȣ�Ӧʹ��ƿC��Na2S��Na2SO3ǡ����ȫ��Ӧ����ƿC�з�����Ӧ����Na2S2O3��aq������Ӧ��ֹ����ƿC�е���Һ������Ũ������ȴ�ᾧ��������Na2S2O3���壬Dװ���н����̣ܶ�Ŀ���Ƿ�ֹ������E��ʢ��NaOH��Һ����β����������ֹ�������ŷ��ڻ����У�
��1�����ڱ�װ����������μӣ�����ʵ��ǰҪ����װ�õ������ԣ�D�����Ϊ�̵��ܣ�Ϊ��ȫƿ����ֹ������װ��E������β����SO2��H2S�����ã�
��2����������������ˮ���������ᣬΪ��ֹ���������ܽ⣬Ӧ����������������Һϴ����
��3���ٶ���������̼���Ʒ�Ӧ�������������ƣ�
��Na2S2O3����Ҫ����Na2CO3��Na2SO3�������ʣ������ܽ�����ߣ�Na2CO3��Na2SO3�ܽ�����¶�Ӱ���С����Na2S2O3���¶�Ӱ��ϴݴ˴��⣻
��4������K2Cr2O7��Һ�м��������KI���壨Cr2O72-����ԭ��Cr3+�������μӼ��ε�����Һ����ʱ��Һ����ɫ����Na2S2O3��Һ�ζ������ﵽ�ζ��յ�ʱ����Һ��ɫ����ȥ��K2Cr2O7�����ʵ���Ϊ0.1mol/L��0.02L=0.002mol�����ݷ�ӦCr2O72-+6I-+14H+=2Cr3++3I2+7H2O��֪��I2�����ʵ���Ϊ0.006mol�����ݷ�ӦI2+2S2O32-=2I-+S4O62-����֪Na2S2O3�����ʵ���Ϊ0.012mol���ݴ˼���ò�Ʒ�Ĵ��ȣ�
��� �⣺��1��������װ��ɺر����˻�������װ��B�еij���©����ע��Һ�����γ�һ��Һ������Һ���߶ȱ��ֲ��䣬�����������ã�������װ���еij���©����ע��һ������Һ�壬��Ŀ���Ǽ���װ�õ������ԣ�D�����Ϊ�̵��ܣ�Ϊ��ȫƿ����ֹ������װ��E������β����SO2��H2S�����ã���ѡ��NaOH��Һ��
�ʴ�Ϊ������װ�õ������ԣ���ֹ������NaOH��
��2����������������ˮ���������ᣬ����������������ơ�̼�����Ʒ�Ӧ��Ϊ��ֹ���������ܽ⣬Ӧ����������������Һϴ������ѡc��
��3���ٶ���������̼���Ʒ�Ӧ�������������ƣ���Ӧ�ķ���ʽΪNa2CO3+SO2=Na2SO3+CO2��
�ʴ�Ϊ��Na2CO3+SO2=Na2SO3+CO2��
��Na2S2O3����Ҫ����Na2CO3��Na2SO3�������ʣ������ܽ�����ߣ�Na2CO3��Na2SO3�ܽ�����¶�Ӱ���С����Na2S2O3���¶�Ӱ��ϴ����Դӻ����Һ���Ƶ�Na2S2O3�IJ�������Ϊ����Ũ�������½ᾧ�����ˡ�ϴ�ӡ����
�ʴ�Ϊ������Ũ�������½ᾧ��
��4������K2Cr2O7��Һ�м��������KI���壨Cr2O72-����ԭ��Cr3+�������μӼ��ε�����Һ����ʱ��Һ����ɫ����Na2S2O3��Һ�ζ������ﵽ�ζ��յ�ʱ����Һ��ɫ����ȥ�����Եζ��յ����������Һ����ɫǡ�ñ����ɫ���Ұ���Ӳ��ָ���K2Cr2O7�����ʵ���Ϊ0.1mol/L��0.02L=0.002mol�����ݷ�ӦCr2O72-+6I-+14H+=2Cr3++3I2+7H2O��֪��I2�����ʵ���Ϊ0.006mol�����ݷ�ӦI2+2S2O32-=2I-+S4O62-����֪Na2S2O3�����ʵ���Ϊ0.012mol������2.0g��Ʒ����Na2S2O3������Ϊ0.012mol��158g/mol=0.1896g�����Բ�Ʒ�Ĵ���Ϊ$\frac{0.1896g}{2g}$��100%=94.8%��
�ʴ�Ϊ����Һ����ɫǡ�ñ����ɫ���Ұ���Ӳ��ָ���94.8%��
���� ���⿼����ʵ�����������������ԭ��Ӧ�ļ���ȣ���Ŀ�Ѷ��еȣ�Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע���غ�˼����������ԭ��Ӧ������Ӧ�ã�


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2 mol H2O2��ȫ�ֽ�ת�Ƶĵ�����Ϊ0.4 NA | |
| B�� | 1L�ܶ�Ϊ1.84g•cm-3��������Ϊ98%��������Һ�У�������ԭ����Ϊ36.8NA | |
| C�� | �ڳ��³�ѹ�£�2.24 L SO2��O2���������������ԭ����Ϊ0.2 NA | |
| D�� | �ڱ�״���£�2.8 g N2��2.8 g CO������������Ϊ1.4 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
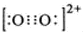 ��1mol O22+�к��еĦм���ĿΪ2NA��
��1mol O22+�к��еĦм���ĿΪ2NA���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
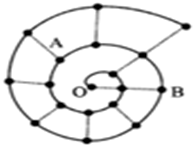 ijͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų���ͼ��ʾ�ġ���ţ����״��ͼ��ÿ�������ϵġ���������һ��Ԫ�أ�����O�������Ԫ�أ�����˵���д�����ǣ�������
ijͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų���ͼ��ʾ�ġ���ţ����״��ͼ��ÿ�������ϵġ���������һ��Ԫ�أ�����O�������Ԫ�أ�����˵���д�����ǣ�������| A�� | ��O��ԽԶ��Ԫ��ԭ�Ӱ뾶��һ��Խ�� | |
| B�� | ͼ��ֱ��������Ԫ�ش��ڲ���ͬһ�� | |
| C�� | BԪ����ͼ�н�������ǿ��Ԫ�� | |
| D�� | A��B����Ԫ����ɵĻ������п��ܺ��й��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe��OH��3��Fe2O3��Fe | B�� | NH3��NO��NO2��HNO3 | C�� | S��SO3��H2SO4 | D�� | Cl2��HClO��NaClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Cr���������ֻ�����ڹ�ҵ�������й㷺����;��
����Cr���������ֻ�����ڹ�ҵ�������й㷺����;���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
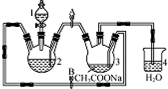 �����Ǹ�ˮ����{[Cr��CH3COO��2]2•2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���dz��õ��������ռ���ʵ��������п�������Ȼ�����Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��������2��Ԥ�ȼ���п������֪���۸����ȶ������ױ���������������п��Ӧ���Ʊ������з�������ط�Ӧ���£�
�����Ǹ�ˮ����{[Cr��CH3COO��2]2•2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���dz��õ��������ռ���ʵ��������п�������Ȼ�����Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��������2��Ԥ�ȼ���п������֪���۸����ȶ������ױ���������������п��Ӧ���Ʊ������з�������ط�Ӧ���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KMnO4��Һ | B�� | KBr��Һ | C�� | ��ˮ | D�� | AgNO3��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com