
| A. | H2SO4 HCl Mg(OH)2 MgCl2 | B. | CO2 H2CO3 Na2CO3 Ca(HCO3)2 | ||
| C. | H2O HNO3 NaOH KNO3 | D. | SO3 NaHCO3 NaOH Na2SO4 |
分析 电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子(或铵根离子)和酸根离子组成的化合物是盐.氧化物是由两种元素组成并且一种元素是氧元素的化合物.
解答 解:A、H2SO4属于酸,HCl属于酸,氢氧化镁属于碱,氯化镁是由金属离子和酸根离子组成的化合物,属于盐,故A错误;
B、二氧化碳属于氧化物,碳酸属于酸,Na2CO3 和Ca(HCO3)2属于盐,故B错误;
C、水属于氧化物,硝酸属于酸,氢氧化钠属于碱,硝酸钾属于盐,故C正确;
D、三氧化硫属于氧化物,碳酸氢钠属于盐,氢氧化钠属于碱,硫酸钠属于盐,故D错误.
故选C.
点评 本题考查酸、碱、盐以及氧化物的概念及分类,难度不大,注意把握概念,从电离的角度把握酸碱盐的实质以及识记物质的俗名.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | Na2CO3溶液中滴加酚酞呈红色,加热红色变浅 | |
| C. | 0.1mol•L-1的Na2CO3溶液中c(Na+)>2c(CO32-) | |
| D. | 相同温度下,CaCO3在饱和Na2CO3溶液中的KSP比在纯水中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
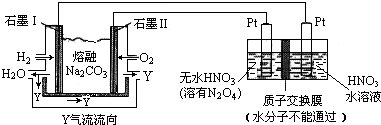
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 | |
| B. | 化学反应必定同时遵循质量守恒和能量守恒 | |
| C. | 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 | |
| D. | 已知:C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol 铁放入足量的浓硫酸中转移的电子数为0 | |
| B. | 在标准状况下,4.48 L氧单质含有的氧原子数目为0.4NA | |
| C. | 在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| D. | 0.1 mol N5+ 微粒中含有的电子数为3.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
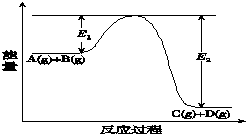 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  蒸发FeCl3溶液得氯化铁晶体 蒸发FeCl3溶液得氯化铁晶体 | |
| B. |  测量氯气的体积 测量氯气的体积 | |
| C. |  作为制取少量SO2的尾气吸收装置 作为制取少量SO2的尾气吸收装置 | |
| D. |  制备Fe(OH)2并能较长时间观察其颜色 制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com