
A、 |
B、 |
C、 |
D、 |
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
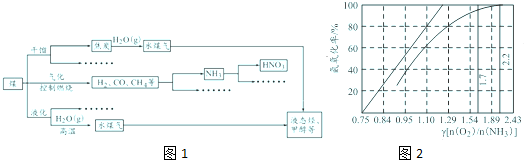
| 在微生物作用下 |
| O2/H2O |
| 在微生物作用下 |
| O2/H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验现象或结论 | 原因或原理 |
| A | 铜丝在硫蒸气中燃烧生成黑色物质 | Cu+S=CuS |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuCl2的Ksp比Zn Cl2的Ksp小 |
| C | MgO可以除去MgCl2溶液中的FeCl3 | MgO消耗了溶液中的H+,碱性增强,使Fe3+沉淀下来 |
| D | 向豆浆中加入硫酸钙可制成豆腐 | 硫酸钙转化为更难溶的沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰可以用于人工降雨 |
| B、推广使用可降解塑料,有助于减少“白色污染” |
| C、将熟石灰和硝酸铵混合施用,肥效更高 |
| D、环境保护应从源头消除污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通过无水氯化钙粉末 |
| B、氢气通过灼热的氧化铜粉末 |
| C、铝与氧化铁发生铝热反应 |
| D、将锌粒投入到硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
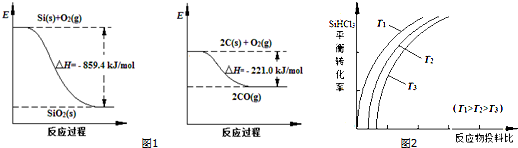
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO2 | 11.9 | 15.8 | 21.0 | 27.0 | -* | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com