
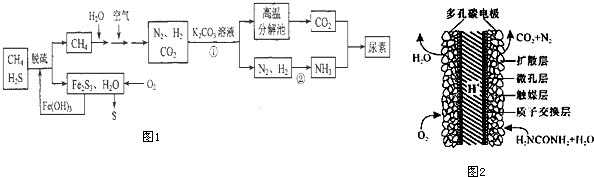
分析 以天然气(含H2S)为原料,加入氢氧化铁脱硫得到甲烷和Fe2S3,通入氧气发生反应生成氢氧化铁和硫单质,氢氧化铁循环使用,甲烷和空气水混合反应得到氮气、二氧化碳和氢气,通入碳酸钾溶液发生反应得到碳酸氢钾,高温分解生成二氧化碳,氮气和氢气一定条件下反应生成氨气,二氧化碳和氨气反应得到尿素;
(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动;可逆反应N2(g)+3H2(g)?2NH3(g)达到平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度、百分含量不再变化;该反应是气体体积缩小的反应,反应过程中压强会发生变化,据此进行判断;
(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,以此计算;
(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳.
解答 解:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾,其离子反应为CO32-+CO2+H2O═2HCO3-,
故答案为:CO32-+CO2+H2O═2HCO3-;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S,
故答案为:2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小,N2+3H2?2NH3 △H<0,反应是气体体积减小的放热反应,
A.反应速率之比等于化学方程式计量数之比,单位时间内生成nmol N2同时消耗3nmol H2,说明正逆反应速率相同,反应达到平衡状态,故A正确;
B.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量发生变化,气体质量不变混合气体的平均摩尔质量不变 说明反应达到平衡状态,故C正确;
D.N2、H2、NH3浓度之比为1:3:2不能说明反应达到平衡状态,故D错误;
故答案为:减小,AC;
(4)H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应生成氨基甲酸和一水合氨,反应的离子方程式为:H2NCOO-+NH4++H2O?H2NCOOH+NH3●H2O,
故答案为:H2NCOO-+NH4++H2O?H2NCOOH+NH3●H2O;
(5)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为$\frac{120×1{0}^{6}g}{60g/mol}$×22.4L/mol×10-3m3=4.48×104m3,
故答案为:4.48×104;
(6)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+,
故答案为:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
点评 本题以尿素的合成为信息考查化学用语及化学平衡、电化学等知识,综合性较强,题目难度中等,(5)为学生解答的难点和易错点.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
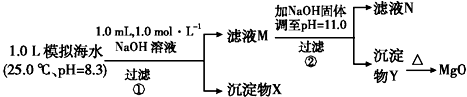
| 模拟海水中的离 子浓度/mol•L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A. | 沉淀物X为CaCO3、MgCO3 | |
| B. | 滤液M中存在Mg2+,Ca2+ | |
| C. | 滤液N中存在Ca2+,没有Mg2+ | |
| D. | 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、钾着火,应立即用水扑灭 | |
| B. | 燃着的酒精灯打翻失火,应立即用水浇灭 | |
| C. | 蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 | |
| D. | 皮肤上沾有少量浓碱,可立即用大量水冲洗,再涂上3%~5%的硼酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (X)为卤素原子.
(X)为卤素原子.
 ;
; ;
; +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +NaCl;
+NaCl; 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt非常稳定 | |
| B. | AgAt难溶于水 | |
| C. | 砹的非金属性在卤素中是最弱的,At-易被氧化 | |
| D. | 砹难溶于水,易溶于四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com