
����Ŀ����ͭ�ǹ㷺Ӧ�������������Ԫ�������úϽ�ij����С���ij����ͭԪ��(��25%BeO��71%CuS������FeS��SiO2)�л������ͭ���ֽ����Ĺ���������ͼ��

��֪����.�롢��Ԫ�صĻ�ѧ�������ƣ�������������������Һ��Ӧ���ɿ�����ˮ��Na2BeO2
��.�����²�����������ܶȻ��������±���
������ | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
�ܶȻ�����(Ksp) | 2.2��10-20 | 4.0��10-38 | 2.1��10-13 |
��1����ҺA����Ҫ�ɷֳ�NaOH�⣬����___(�ѧʽ)��д����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽ��___��
��2����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊ___(����ĸ)��
a.��������İ�ˮ
b.ͨ�������CO2
c.���������NaOH
d.����������HCl
e.ϴ��
f.����
��3����MnO2�ܽ����������е���Ԫ������Ϊ���ʡ�д����Ӧ����CuS������Ӧ�Ļ�ѧ����ʽ��___��
������ŨHNO3�ܽ�������ȱ����___(��дһ��)��
��4����ҺD��c(Cu2+)=2.2mol��L-1��c(Fe3+)=0.008mol��L-1��c(Mn2+)=0.01mol��L-1����μ���ϡ��ˮ����pH�ɽ������η��룬���ȳ�������___(�����ӷ���)��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����___��
��5�����NaCl-BeCl2������ο��Ʊ������룬��ͼ�ǵ��װ��ͼ��
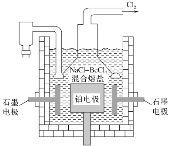
��ʯī�缫�ϵĵ缫��ӦʽΪ___��
�ڵ��õ���Be������Լ��1%��Na��������ȥBe������Na�ķ���Ϊ___��
��֪�������ʵ��ۡ��е����±���
���� | �۵�(K) | �е�(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
���𰸡�Na2BeO2��Na2SiO3 BeO22-+4H+=Be2++2H2O afed MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O ������Ⱦ���������� Fe3+ 4 Be2++2e-=Be �����¶�1156��3243K֮����ȴ
��������
����ɹ�������ͼ������֪���Ͼ���ͭԪ��(��BeO��25%��CuS��71%������FeS��SiO2)��������������Һ���˵õ���ҺAΪNaOH��Na2SiO3��Na2BeO2����ҺA�м������������˵õ�����Ϊ���ᣬ��ҺC��ҪΪ��NaCl��BeCl2������HCl����������İ�ˮ���ˣ�ϴ�Ӽ���������HCl �õ��Ȼ�����Һ������Ũ����ȴ�ᾧ�õ����壬һ�������·�Ӧ�õ��룬����B�м���������̵�ϡ���ᷢ����ӦMnO2�ܽ����������е���Ԫ������Ϊ���ʣ����˵õ��������ҺD����ҺD�к�c(Cu2+)��c(Fe3+)��c(Mn2+)����μ���ϡ��ˮ����pH�����η��룬���һϵ�в����õ�ͭ��
(1)��������������֪����ҺA����Ҫ�ɷֳ�NaOH�⣬����Na2BeO2��Na2SiO3����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽΪBeO22-+4H+=Be2++2H2O���ʴ�Ϊ��Na2BeO2��Na2SiO3��BeO22-+4H+=Be2++2H2O��
(2)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊafed����������İ�ˮ�к����ᡢ����Be2+��Ȼ����ˡ�ϴ�ӳ�����������������HCl�������ܽ⼴�ɣ��ʴ�Ϊ��afed��
(3)��MnO2�ܽ����������е���Ԫ������Ϊ���ʣ���ˣ���Ӧ����CuS������Ӧ�Ļ�ѧ����ʽΪCuS+MnO2+2H2SO4=CuSO4+MnSO4+S+2H2O���ʴ�Ϊ��CuS+MnO2+2H2SO4=CuSO4+MnSO4+S+2H2O��
������HNO3�������Ժ�ǿ���ڷ�Ӧ�л��������������Կ��������Ⱦ���������Dz�ѡ��Ũ���ᣬ�ʴ�Ϊ���������Ⱦ���������壻
(4)��ҺD��c(Cu2+)=2.2mol��L��1��c(Fe3+)=0.008mol��L��1��c(Mn2+)=0.01mol��L��1����μ���ϡ��ˮ����pH�ɽ������η��롣Cu2+��ʼ����ʱ��c(OH-)=![]() mol/L=10-10mol/L��pH=4��Fe3+��ʼ����ʱ��c(OH-)=
mol/L=10-10mol/L��pH=4��Fe3+��ʼ����ʱ��c(OH-)=![]() mol/L=
mol/L=![]() mol/L��Mn2+��ʼ����ʱ��c(OH-)=
mol/L��Mn2+��ʼ����ʱ��c(OH-)=![]() mol/L��1.45��10-5mol/L����ˣ����ȳ�������Fe3+��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����4���ʴ�Ϊ��Fe3+��4��
mol/L��1.45��10-5mol/L����ˣ����ȳ�������Fe3+��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����4���ʴ�Ϊ��Fe3+��4��
(5)��ʯī�缫���ɽ���Be���缫��Ӧ����ʽΪ��Be2++2e-=Be���ʴ�ΪBe2++2e-=Be��
��ͼ����Ϣ��֪Na��Be���۷е���ܴ���Na������Be�������Կ����¶�1156~3243K֮����ȴ���ʴ�Ϊ���Կ����¶�1156~3243K֮����ȴ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ���� 0.10 mol��L��1 CH3COOH ��Һ�μӵ� 10 mL 0.10 mol��L��1 NaOH ��Һ�У�lg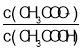 ��pH �Ĺ�ϵ��ͼ��ʾ��C �������ǣ�6��1.7��������˵������ȷ����
��pH �Ĺ�ϵ��ͼ��ʾ��C �������ǣ�6��1.7��������˵������ȷ����
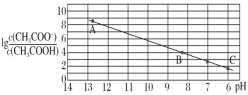
A.pH��7 ʱ����Ĵ�����Һ��������� 10 mL
B.C ���������������Һ��ˮ�ĵ���̶ȼ�С
C.B ����� c��Na������c��CH3COO��������10��6��10��8��mol��L��1
D.Ka��CH3COOH����10��4.3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. Cl2��H2O�ķ�Ӧ��Cl2��H2O![]() 2H����Cl����ClO��
2H����Cl����ClO��
B. ͭ˿����Fe2(SO4)3��Һ�У�Cu +Fe3+ =Cu2+ +Fe2+
C. ��FeBr2��Һ��ͨ�����Cl2��2Br��+Cl2=Br2+2Cl��
D. ��Na2SiO3��Һ��ͨ�����CO2��SiO32-+2CO2+2H2O=H2SiO3��+2HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
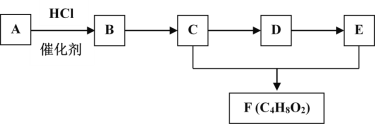
����Ŀ���л���A~F��ת����ϵ����ͼ��ʾ����֪A�ڱ�״���µ��ܶ�Ϊ1.25gL��1��D�ܷ���������Ӧ��F��������ˮ���з�����ζ����״Һ�塣
��ش�
��1��A�й���������Ϊ________��
��2��C��D�ķ�Ӧ������_________��
��3��A��Eһ��������Ҳ������F�Ļ�ѧ����ʽ��_______��
��4������˵����ȷ����______��
A��A��B����ʹ����KMnO4��ɫ
B��D��E��������������ͭ����Һ����
C�������ñ���̼������Һ��ȥC��E��F������е�C��E
D���Ʋ��л���F�����������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ��Ƴɷ��к���������ͪ�����ʡ��ӷ��͡��л��ӡ����ǵ�����ɷ֣�����һ���л��ӵĽṹ��ʽ��ͼ������˵����ȷ���ǣ� ��
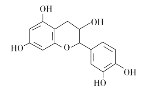
A.����������̼ԭ�ӿ��Դ���ͬһƽ��
B.�����к���2������ԭ��
C.1mol���л��������Ũ��ˮ��Ӧ���������5molBr2
D.1mol���л�����NaOH��Һ��Ӧ�������5molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Na2CO3��NaHCO3��ɵĻ��������ˮ���50 mL��Һ����μ���ϡ���ᣬ�õ����ɷ����ʵ����仯��ͼ��ʾ(������Һ��ϵ��µ�����仯����֪1 mol=1000 mmol)��
����˵������ȷ����
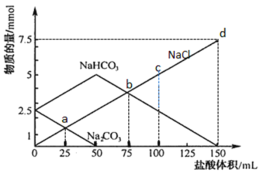
A.��������ʵ���Ũ��Ϊ0.05 mol��L-1
B.c����Һ��c(NaCl)=0.05 mol��L-1
C.a����Һ�з�����Ӧ�����ӷ���ʽΪ��CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b���d����������Һ��n(Na+)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����и��������У�����֮��ͨ��һ����Ӧ��ʵ����ͼ��ʾת������( )
����ת����ϵ | a | b | c | d | |
A |
| FeCl2 | FeCl3 | Fe | CuCl2 |
B | SO2 | SO3 | S | H2SO4 | |
C | CH2ClCH2Cl | CH��CH | CH2OHCH2OH | CH2=CH2 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����������պ����������Ҫ�ɷ�ΪFe2O3�� SiO2��A12O3���������������ʣ���ȡ�̼�FeSO47H2O)��������������̣�������������ȥ����
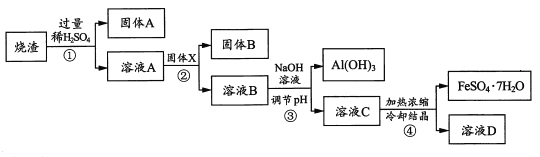
��ش�
��1����һ�����漰��ʵ����������У��������˵���____��д��ţ���
��2��д�����з�Ӧ�����ӷ���ʽ��____��
��3������˵����ȷ����___������ĸ����
a������x����
b����ҺB�к��е���������Ҫ��Fe2����Fe3+��Al3+
c������ҺC���̷��Ĺ����У������������ֹ������
��4��Ϊ�ⶨ������Fe2O3�ĺ�������ͬѧͨ��ʵ�����������ݣ�����������Ϊag������x������Ϊbg������B������Ϊcg����ͬѧ��Ϊ�����������������������������Fe2O3�ĺ�������������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y������Ԫ�أ�IΪ�����ܣ���λ��KJ/mol�������±����������жϴ�����ǣ� ��
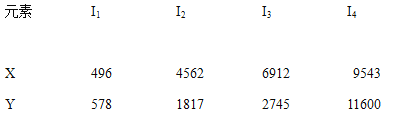
A. Ԫ��X�ij������ϼ���+1��
B. Ԫ��Y����A���Ԫ��
C. Ԫ��X�����γɻ�����ʱ����ѧʽ������XCl
D. ��Ԫ��Y���ڵ�3���ڣ���������ˮ���ҷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com