
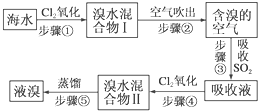
分析 海水中通入氯气氧化溴离子得到溴水的混合溶液,用热空气吹出溴单质得到含溴的空气,通过二氧化硫吸收后富集溴元素得到吸收液,再通入氯气氧化溴化氢得到溴水的混合溶液,蒸馏得到溴单质,
(1)海水中的溴离子容易被氯气氧化为溴的单质,氧化性氯气比溴强;
(2)溴单质有氧化性,二氧化硫具有还原性,溴和二氧化硫在水溶液中易发生氧化还原反应;
(3)溴单质和氢氧化钠溶液反应,和还原性的物质发生氧化还原反应;
(4)溴元素在周期表中和氯元素同主族,位于氯元素的下面,本族的三、四周期元素的原子序数相差18;
(5)溴的沸点是58.5°C,温度控制过高,水会沸腾,温度过低,溴蒸气不易挥发;
(6)溴水混合物I的组成有水、液溴还有含有氯离子的盐等成分.
解答 解:(1)氧化性氯气比溴强,溴离子容易被氯气氧化为溴的单质,反应为:2Br-+Cl2=2Cl-+Br2,
故答案为:2Br-+Cl2=2Cl-+Br2;
(2)溴单质有氧化性,二氧化硫具有还原性,二者之间的反应为:SO2+Br2+2H2O=2HBr+H2SO4,
故答案为:SO2+Br2+2H2O=2HBr+H2SO4;
(3)下列物质也能吸收Br2的是,
A.NaOH溶液和溴单质反应生成溴化钠、次溴酸钠和水,可以吸收,故A正确;
B.FeCl2 溶液具有还原性,可以被溴单质氧化为氯化铁,可以吸收溴单质,故B正确;
C.Na2SO3 溶液具有还原性,可以被溴单质氧化,能吸收溴单质,故C正确;
D.H2O和溴单质反应微弱,不能充分吸收溴单质,故D错误;
故答案为:ABC;
(4)溴元素在周期表中和氯元素同主族,位于氯元素的下面,本族的三、四周期元素的原子序数相差18,氯的原子序数为17,则溴为35,在第四周期第ⅤⅡA族,故答案为:35;
(5)溴的沸点是58.5°C,温度应控制在80~90℃最佳,温度控制过高,水会沸腾,溴蒸气中有水,温度过低,溴蒸气不易挥发,
故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(6)溴水混合物I的组成有水、液溴还有含有氯离子的盐等成分,要获得溴,应采用分馏操作,给实验带来很多麻烦,“溴水混合物Ⅰ”中虽然有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高,而“溴水混合物Ⅱ”实际上将溴水浓缩了
故答案为:“溴水混合物Ⅰ”中虽然有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高,而“溴水混合物Ⅱ”实际上将溴水浓缩了.
点评 本题考查了有关卤素性质的实验题,考查了学生分析和解决问题的能力,掌握物质性质是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子的核电荷数依次增多 | B. | 原子核外电子层数依次增多 | ||
| C. | 原子核外次外层电子数依次增多 | D. | 原子量依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能发生取代反应 | B. | C4H10(丁烷)有三种同分异构体 | ||
| C. | 氨基酸、淀粉均属于高分子化合物 | D. | 油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO4浓溶液和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯中含有碳碳双键,其性质跟乙烯相似 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液:2c(R2-)+c(HR-)=c(Na+) | |
| B. | 若将CO2通入0.1mol•L-1 Na2CO3溶液中至溶液中性,则溶液中c(H+)-c(CO32-)=c(OH-)-c(H2CO3) | |
| C. | 将c mol•L-1 的醋酸溶液与0.02mol•L-1 NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示醋酸的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com