
【题目】在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②; .
③; .
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为;
(3)该反应的△H0,其判断理由是
(4)该反应进行到4.0min时的平均反应速率:
实验②:vB=
实验③:vc= .
【答案】
(1)加催化剂,达到平衡的时间缩短,平衡时A的浓度未变,温度升高,达到平衡的时间缩短,平衡时A的浓度减小
(2)40%,0.06mol/L
(3)>,温度升高,平衡向正反应方向移动
(4)0.014mol(L?min)﹣1,0.009mol(L?min)﹣1
【解析】解:(1)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
所以答案是:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小;
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L﹣0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为 ![]() ×100%=40%;
×100%=40%;
实验③平衡时A的浓度为0.04mol/L,故A的浓度变化量0.1mol/L﹣0.04mol/L=0.06mol/L,由方程式可知C的浓度变化量为0.06mol/L,故平衡时C的浓度为0.06mol/L,
所以答案是:40%;0.06mol/L;
(3)因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
所以答案是:>;温度升高,平衡向正反应方向移动;
(4)实验②中,vA= ![]() =0.007mol(Lmin)﹣1,所以vB=2vA=0.014mol(Lmin)﹣1;
=0.007mol(Lmin)﹣1,所以vB=2vA=0.014mol(Lmin)﹣1;
实验③中,vA= ![]() =0.009mol(Lmin)﹣1,所以vC=vA=0.009mol(Lmin)﹣1,
=0.009mol(Lmin)﹣1,所以vC=vA=0.009mol(Lmin)﹣1,
所以答案是:0.014mol(Lmin)﹣1;0.009mol(Lmin)﹣1.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】有关下列图象说法错误的是( )
A.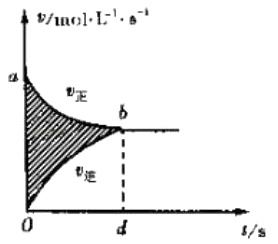
图阴影部分面积表示反应物浓度的净减少量M
B.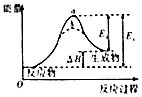
图虚线b表示反应加入催化剂后能量变化曲线
C.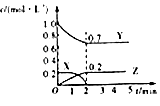
图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)2Z(g)
D.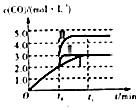
图对应于反应H2(g)+CO2(g)H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是( )
A.用焰色反应鉴別Na2CO3溶液和K2CO3溶液
B.用分液漏斗分离食醋中的乙酸与水
C.用丁达尔现象检验NaCl溶液中是否含有淀粉胶体
D.用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析图中的信息,下列说法不正确的是

A. 1molH2和1/2molO2参加反应,结果放出930kJ的热量
B. 破坏旧化学键,需要吸收一定的能量来克服原子间的相互作用力
C. 该反应中断键所吸收的能量比成键所放出的能量少
D. 该反应中,H2、02分子分裂为H、O原子,H、O原子重新组合成水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图表中a、b、c表示对应装置的仪器中加入的试剂,可制取、净化、收集的气体是
选项 | a | b | c | 气体 | 装置 |
A | 浓氨水 | 生石灰 | 浓硫酸 | NH3 |
|
B | 浓H2SO4 | 铜屑 | NaOH溶液 | SO2 | |
C | 稀HNO3 | 铜屑 | H2O | NO | |
D | 稀盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | CO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的金属铁与下列酸溶液反应,初始反应速率最快且最终产生氢气最多的是( )
A.100mL0.1mol/L盐酸
B.100mL0.2mol/L硝酸
C.75 mL0.2mol/L盐酸
D.20mL18.4mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.2.7g金属铝变为铝离子时得到的电子数目为0.3NA
B.0.5molO3与11.2L O2所含的分子数一定相等
C.14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D.22.4LCO2与CO的混合气体中含碳原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数都相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)C两种元素的名称分别为________。
(2)用电子式表示离子化合物A2B的形成过程:_______________。
(3)写出D元素形成的单质的结构式:________________________。
(4)写出下列物质的电子式:
A、B、E形成的化合物:________________;D、E形成的化合物:__________________。
(5)A、B两种元素组成的化合物A2B2属于________(填“离子”或“共价”)化合物,存在的化学键类型是____________;写出A2B2与水反应的化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com