
| 几种难溶电解质的Ksp(25℃) | |
| 沉淀溶解平衡 | Ksp |
AgBr(s) Ag+(aq)+Br-(aq) | 5,0×10-13mol2?L-2 |
AgI(s) Ag+(aq)+I-(aq) | 8.3×10-17mol2?L-2 |
FeS(s) Fe2+(aq)+S2-(aq) | 6.3×10-18mol2?L-2 |
ZnS(s) Zn2+(aq)+S2-(aq) | 1.6×10-24mol2?L-2 |
CuS(s) Cu2+(aq)+S2-(aq) | 1.3×10-36mol2?L-2 |


科目:高中化学 来源: 题型:
| A、由于非金属性B>D,则A、B组成化合物的沸点高于A、D组成的化合物 |
| B、在C、B形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C、原子半径由大到小排列的是:C>D>E>B>A |
| D、B、C、E三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、铝粉溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
| C、在酸性的硫酸亚铁溶液中加入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O |
| D、硫化氢气体通入氯化铁溶液中:Fe3++H2S=Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3???H++HCO3- HCO3-???H++CO32- | K1=4.31×10-4 K2=5.61×10-11 | |
| C6H5OH | C6H5OH???C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4???H++H2PO4- H2PO4-???H++HPO42- HPO42-???H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3?H2O | NH3?H2O???NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4??Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3???Ba2++CO32- | 2.58×10-9 |
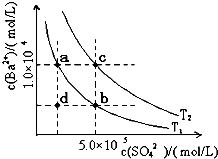 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入稀有气体使压强增大,平衡向正反应方向移动 |
| B、x的正反应速率是y的逆反应速率的n/m倍 |
| C、降低温度,混合气体的平均相对分子质量变大 |
| D、增加X的物质的量,y的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com