
| 选项 | 实验操作及其现象 | 实验结论 |
| A | 取某卤代烃少许与NaOH的乙醇溶液共热,然后将产生的气体通过酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色 | 卤代烃与NaOH的乙醇溶液共热生产了烯烃 |
| B | 向铝制易拉罐中充满CO2,然后向罐内注入足量的浓NaOH,立即用胶布封住罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来 | NaOH溶液即可吸收CO2,又可与金属铝反应产生气体 |
| C | 取2mL 0.1mol•L-1 AgNO3溶液,滴入1mL 0.1mol•L-1 KSCN溶液,静置后,向上层清液中滴入FeCl3溶液,溶液变红 | 溶液中仍然有SCN- |
| D | 将在空气中灼烧过的呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变为红色,反复数次,试管中的液体有刺激性气味 | 在此反应中铜丝作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.卤代烃少许与NaOH的乙醇溶液共热,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
B.注入足量的浓NaOH,与二氧化碳反应生成碳酸钠,后Al与NaOH溶液反应生成氢气;
C.存在Ag++SCN-?AgSCN↓平衡;
D.Cu与氧气反应生成CuO,CuO与乙醇反应生成乙醛.
解答 解:A.卤代烃少许与NaOH的乙醇溶液共热,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,应除去乙醇后,再通过酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色检验乙烯,故A错误;
B.注入足量的浓NaOH,与二氧化碳反应生成碳酸钠,后Al与NaOH溶液反应生成氢气,则罐壁立即内陷,一段时间后,罐壁又重新鼓起来,现象与结论均合理,故B正确;
C.存在Ag++SCN-?AgSCN↓平衡,则向上层清液中滴入FeCl3溶液,溶液变红,可知溶液中仍然有SCN-,故C正确;
D.Cu与氧气反应生成CuO,CuO与乙醇反应生成乙醛,则在此反应中铜丝作催化剂,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、平衡移动、氧化还原反应等,把握反应原理及物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

 CH3COOCH2CH2OOCCH3+2H2O.
CH3COOCH2CH2OOCCH3+2H2O.
 、
、 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
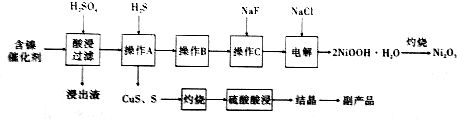
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
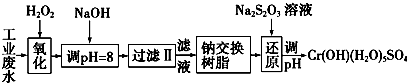
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都等于零 | B. | SO2、O2、SO3的浓度相等 | ||
| C. | SO2、O2、SO3在容器中共存 | D. | SO2、O2、SO3的浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com