
| A. | c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液 | |
| B. | c(H+)=1.0×10-7mol•L-1的溶液 | |
| C. | pH=7的溶液 | |
| D. | 室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
分析 只要溶液中存在c(H+)=c(OH-),则该电解质水溶液一定呈中性,不能根据溶液中c(H+)大小、溶液的pH判断溶液酸碱性,据此分析解答.
解答 解:A.c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液,根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)得c(H+)=c(OH-),则该电解质溶液呈中性,故A正确;
B.c(H+)=1.0×10-7mol•L-1的溶液中无法比较c(H+)、c(OH-)相对大小,所以无法判断溶液酸碱性,故B错误;
C.95℃时纯水pH=6,则该温度下pH=7的溶液呈碱性,所以温度未知时不能根据pH判断溶液酸碱性,故C错误;
D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液,要根据酸、碱的相对强弱判断溶液酸碱性,如果酸是弱酸、碱是强碱,则混合溶液呈酸性;如果酸是强酸、碱是强碱,则混合溶液呈中性,如果酸是强酸、碱是弱碱,则混合溶液呈碱性,故D错误;
故选A.
点评 本题考查电解质溶液酸碱性判断,为高频考点,电解质溶液酸碱性要根据c(H+)、c(OH-)相对大小判断,温度未知时不能根据pH判断,易错选项是C.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2中含有共价键,故是共价化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,但化学性质几乎相同 | |
| D. | Fe(OH)3胶体是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 相同条件下,1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,H2的燃烧热为241.8kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,含1molNaOH的NaOH溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的氧化物可用作于耐高温材料 | B. | Na2O2可用作漂白剂 | ||
| C. | 碱石灰可用于干燥CO2、O2等气体 | D. | 小苏打可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
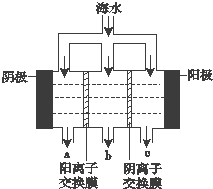 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
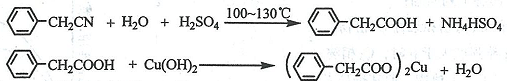
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ/mol | |
| B. | CH3OH转变成H2的过程不一定要吸收能量 | |
| C. | 根据①②推知反应:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.9 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com