
反应2NO(g) + H2(g) → N2(g) + 2H2O(g)的速率表达式为:![]() = kc
= kc![]() c
c![]()
试讨论下列条件变化时对初始速率有何影响?
(1)NO的浓度增加1倍;
(2)有催化剂参加;
(3)温度降低;
(4)反应容器的体积增大1倍。
分析:本题告诉反应的质量作用定律,要求讨论在不同条件下反应初始速率的变化情况。对于(1)和(4)直接使用质量作用定律就可以得出结论;对于(2)和(3)则要根据我们前面讲述的一些情况来考虑。正催化剂加速反应,负催化剂减慢反应,一般来说,升高温度加快反应速率,降低温度减慢反应速率。本题的难度在于对于“初始速率”的理解。我们说化学反应速率和反应物的浓度有关,随着反应的进行,反应物浓度在不断第变化,那么反应的速率也在发生变化,所以不同瞬间,化学反应的速率都是不同的。“初始速率”就是指反应开始这一瞬间反应的速率。
解:(1)当c![]() 增加1倍时,根据
增加1倍时,根据![]() = kc
= kc![]() c
c![]() ,反应速率将增加4倍;
,反应速率将增加4倍;
(2)正催化剂加快反应速率,负催化剂则减慢反应速率;
(3)温度降低,反应速率降低;
(4)当反应容器的体积增大1倍时,c![]() 和c
和c![]() 都减小1倍,所以据
都减小1倍,所以据![]() = kc
= kc![]() c
c![]() ,反应速率将减慢8倍。
,反应速率将减慢8倍。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
汽车尾气中的主要污染物是 及燃料不完全燃烧所产生的 。前者产生的原因是(用化学方程式表示) 。经计算,反应2NO (g)+2CO(g)=N2(g)+2CO2(g)的△H-T△S<0,即这一反应应该是自发进行的,为什么常温常压下大气中的NO和CO不能转化为N2和CO2而净化?
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________。
已知:K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2s内该反应的平均速率v=________________________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________________________。
已知:K(300℃)>K(350℃),该反应是__________热反应(填“放”或“吸”)。
(2)上述反应达平衡时,NO的转化率=__________________。
(3)下图中表示NO2的变化的曲线是____________(选填字母,下同)。
(4)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.NO和NO2两物质的浓度相等
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2015届山东省高一暑假作业(四)化学试卷(解析版) 题型:填空题
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省深圳市南山区高三上学期期末考试化学试卷(解析版) 题型:计算题
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)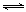 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
(2)恒温恒容,能说明反应 2NO(g) 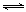 N2(g)+O2(g) 达到平衡的是 (填代号)。
N2(g)+O2(g) 达到平衡的是 (填代号)。
A.NO、N2、O2的浓度之比为2∶1∶1
B.N2的浓度不再发生变化
C.单位时间内消耗2 mol NO,同时消耗1 mol N2
D.容器内气体密度不再发生变化
(3)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
H2(g)+1/2O2(g) = H2O(l) △H = —285.8kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为 。
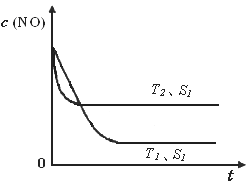
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图是反应:2NO(g) + 2CO(g)  2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2
,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2
,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com