
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
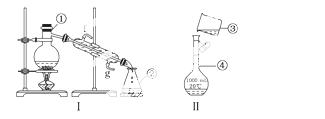
(1)写出下列仪器的名称:
① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的有 (填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;冷凝管的进水口是 (填“f”或“g”);现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是:  。
。
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可化合生成气体G,其水溶液pH>7;Y的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是________。
(2)Y基态原子的核外电子排布式是________;G分子中X原子的杂化轨道类型是________。
(3)L的悬浊液中加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是________________________。
(4)R的一种含氧酸根RO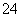 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是________________________。
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列生产或实验事实引出的相应结论不正确的是 ( )
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H=+85.
B(g)+C(g) △H=+85. 1kJ·mol-1
1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a |
| 0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是 ( )
A.950 mL 111.2 g B.500 mL 117.0 g
C.任意规格 111.2 g D.1000 mL  117.0 g
117.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸 液润洗2~3次
液润洗2~3次
D.配制0.1 mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量 瓶中加水稀释
瓶中加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-的物质的量约等于( )
A.0.37 mol B. 0.63 mol C.0.74 mol D.1.5 mol
0.63 mol C.0.74 mol D.1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是 ( )
A.Cu(OH)2难溶于水,属于非电解质
B.SO2能与碱反应生成盐和水,属于酸性氧化物
C.NH4Cl组成中不含金属离子,不属于盐
D.HCl气体溶于水电离成H+和Cl-,属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下氢氧化亚铁与空气中的氧气及水有可能发生反应,即:
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s),已知该反应在298K时的△H=-444.3 kJ·mol—1,△S=-280.1 J·mol—1·K—1
试问该反应在常温下是否自发进行?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com