
| A. |  | B. |  | C. |  | D. |  |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
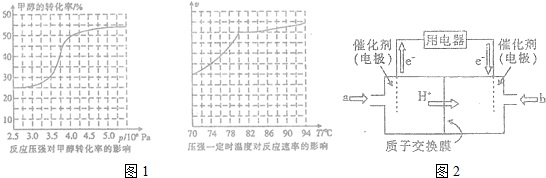
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
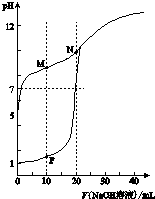 用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
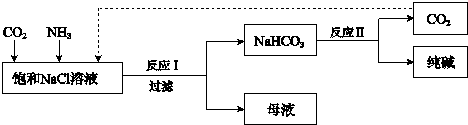
 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
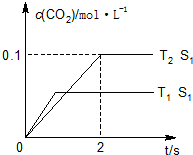 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.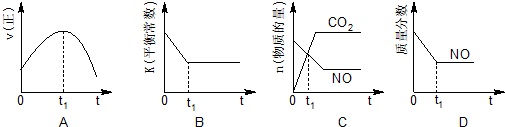
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
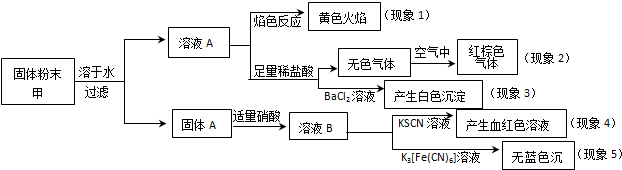
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com