
| A. | 容器中混合气体的质量不随时间变化 | |
| B. | 容器内三种气体 AB、A2、B2共存 | |
| C. | v正(AB)=2v逆(A2) | |
| D. | 单位时间内消耗n mol A2,同时生成2n mol AB |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、容器中混合气体的质量始终不随时间的变化而变化,故A错误;
B、可逆反应永远是反应物和生成物共存的体系,故B错误;
C、当体系达平衡状态时,v正(AB)=2v正(A2)=2v逆(A2),故C正确;
D、单位时间内消耗n mol A2,同时生成2n mol AB,都反应的是逆反应方向,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
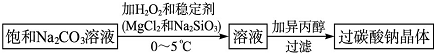
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 加入试剂 | 离子方程式 |
| (1) | 稀HCl | CO32-+2H+=CO2↑+H2O |
| (2) | BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
| (3) | AgNO3溶液 | Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,若电解5min时,铜电极质量增加2.16g.试回答:
如图所示,若电解5min时,铜电极质量增加2.16g.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ④⑤⑦ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
| B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com