
【题目】下列有关氧化还原反应的说法错误的是( )
A. 氧化剂得电子,还原剂失电子
B. 某元素从化合态到游离态,可能被氧化也可能被还原
C. 难失去电子的原子,不一定易得电子
D. 一种元素被氧化,一定有另一种元素被还原
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿( 主要成分MnO2)制高锰酸钾的流程如下(部分条件和产物省略):
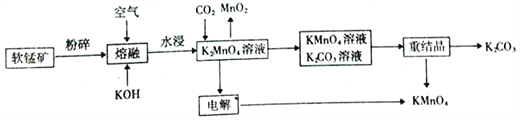
请回答下列问题:
(1)在“水浸”过程中,提高K2MnO4浸出率(浸出的K2MnO4质量与“熔块”质量之比)的措施有_______( 至少写出两点)。
(2)“熔融”过程中发生反应的化学方程式为___________。
(3)CO2 与K2MnO4反应的离子方程式为___________。
(4)“电解”过程中使用的是惰性电极,则:
①阳极反应的方程式为__________。
②阴极附近溶液的pH将__________。(填“增大”“减小” 或“ 不变”)。
(5)在上述过程中产生的Mn2+会对环境造成污染。工业上,通过调节pH使废水中的Mn2+形成Mn(OH)2 沉淀。当pH=10时,溶液中的c(Mn2+)=______(已知:Ksp[Mn(OH)2]=2.0×10-13。相关数据均在常温下测定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 ,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: .
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl﹣) 的关系如图1.①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为 . 
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为(任写一个).
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图2
(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)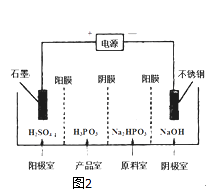
①阳极的电极反应式为: .
②产品室中反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质钛(Ti)的机械强度高,抗腐蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:
①TiO2+2C+2Cl2 ![]() TiCl4+2CO; ②TiCl4+2Mg
TiCl4+2CO; ②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述不正确的是
A. 反应①中TiO2是氧化剂 B. 反应②表现了金属镁还原性比金属钛强
C. 反应①中碳是还原剂 D. 反应①中氧化剂与还原剂物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘具有多种放射性同位素. ![]() I俗称“碘131”,广泛地用于医学诊断作为追踪剂和甲状腺内分泌失调症的治疗.下列有关
I俗称“碘131”,广泛地用于医学诊断作为追踪剂和甲状腺内分泌失调症的治疗.下列有关 ![]() I叙述正确的是( )
I叙述正确的是( )
A.碘元素的相对原子质量为131
B.![]() I是一种新发现的碘的核素
I是一种新发现的碘的核素
C.![]() I位于元素周期表中第4周期ⅦA族
I位于元素周期表中第4周期ⅦA族
D.![]() I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)下列实验操作或对实验事实的描述中,正确的是(填序号)
①为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
②化学药品着火,都要立即用水或泡沫灭火器灭火
③配制一定物质的量浓度的稀硫酸溶液时,量取浓硫酸后的量筒要用蒸馏水洗涤,并把洗涤液转入容量瓶中
④配制一定物质的量浓度的溶液在定容时,俯视容量瓶的刻线,会使配制的浓度偏高
⑤检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
(2)将下列物质进行分类:
①11H 与13H ②O2与O3 ③乙醇与甲醚(CH3﹣O﹣CH3)④ 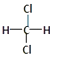 与
与 
⑤CH3CH2CH2CH3与CH3﹣CH(CH3)﹣CH3⑥C60与金刚石 ⑦乙醇与甘油
互为同位素的是(填编号,下同);互为同素异形体的是互为同分异构体的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:_____S2O82-+____Mn2++_____=____MnO4-+____SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
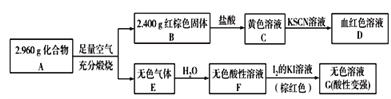
①已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的化学方程式:_______________________。
②已知25 ℃时,Ksp[Fe(OH)3]=8×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数为_________(列式并计算)。向0.001 mol/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为________。(lg 5=0.7)
Fe3++3H2O的平衡常数为_________(列式并计算)。向0.001 mol/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为________。(lg 5=0.7)
(4)①FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2![]() Fe+2Li2S,正极反应式是____。
Fe+2Li2S,正极反应式是____。
②FeSO4可转化为FeCO3,FeCO3在空气中加热会发生反应,可制得铁系氧化物材料。已知25 ℃、101 kPa时:4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)
2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______。
2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com