
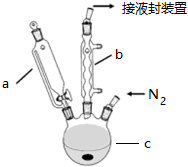
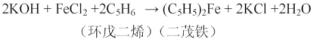
分析 (1)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气;
(2)根据仪器的结构可知仪器c为三颈烧瓶;三颈烧瓶中盛放液体的体积不超过容积的$\frac{2}{3}$分析判断;
(3)仪器d为分液漏斗,分液漏斗检验是否漏水需要检验两处活塞是否漏水;
(4)二茂铁有固体直接变成气体,然后冷凝收集,称为升华;
(5)可以通过测定所得固体的熔点确定;
(6)根据戊二烯计算二茂铁的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气,防止实验过程中亚铁离子被氧化,
故答案为:排尽装置中空气,防止实验过程中亚铁离子被氧化;
(2)仪器c为三颈烧瓶,由题意可知共加入液体110mL,三颈烧瓶中盛放液体的体积不超过容积的$\frac{2}{3}$,所以选择250ml;
故答案为:三颈烧瓶;b;
(3)分液漏斗使用前应进行的操作是:检漏,具体过程:关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞是否漏水,若不漏水,关闭上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水;
故答案为:检漏;关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞是否漏水,若不漏水,关闭上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水;
(4)二茂铁有固体直接变成气体,然后冷凝收集,其操作名称为升华;
故答案为:升华;
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是测定所得固体的熔点;
故答案为:测定所得固体的熔点;
(6)二茂铁的理论产量为$\frac{5.5mL×0.95g/cm{\;}^{3}}{66g/mol}$×$\frac{1}{2}$×186g/mol=7.4g,则产率=$\frac{3.7g}{7.4g}$×100%=50%;
故答案为:50%.
点评 本题以二茂铁的制备实验为载体考查常见仪器的识别,实验方案的分析、评价,化学实验基本操作,物质的分离、提纯和检验,物质结构的测定.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
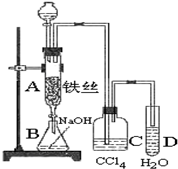 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
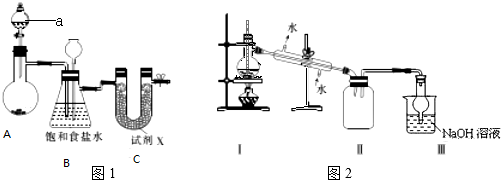
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
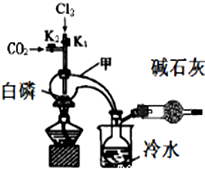 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 )原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)原料,制取苯甲酸甲酯,已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
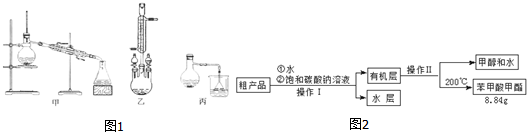
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com