
| A. | 9.2mol/L | B. | 大于9.2mol/L | C. | 小于9.2mol/L | D. | 无法确定 |
科目:高中化学 来源: 题型:选择题
| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 使用容量瓶配制100g 36%的NaCl溶液 | |
| C. | 稀硝酸可除去试管内壁的银镜 | |
| D. | 加热可除去NaHCO3固体中混有的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL0.5mol/LNaCl溶液 | B. | 100mL0.8mol/LNaBr溶液 | ||
| C. | 800mL0.3mol/LNa2CO3溶液 | D. | 1000mL0.6mol/LNaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol氧化剂反应则还原剂失电子的物质的量为5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kb(NH3•H2O) | B. | n(OH-) | C. | $\frac{{c({N{H_3}•{H_2}O})}}{{c({O{H^-}})}}$ | D. | $\frac{{c({O{H^-}})}}{{c({NH_4^+})}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg3N2与盐酸反应能生成两种盐 | B. | CaC2的水解产物是Ca(OH)2和C2H2 | ||
| C. | Si3N4的水解产物之一是H2SiO3 | D. | PCl5的水解产物是HClO和PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
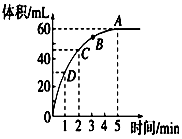 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g•mL-1),在标准状况下放出气体的体积和时间的关系如图所 示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g•mL-1),在标准状况下放出气体的体积和时间的关系如图所 示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,其中Na2O2不属于碱性氧化物 | |
| B. | SiO2是硅酸的酸酐,NO2是HNO3的酸酐 | |
| C. | Fe(OH)3与氢碘酸反应的类型为复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com