
分析 n(Zn)=$\frac{26g}{65g/mol}$=0.4mol,由方程式可知生成0.1molN2O,反应中N元素化合价由+5价降低到+1价,生成0.1molN2O,有0.2mol硝酸被还原,以此解答该题.
解答 解:n(Zn)=$\frac{26g}{65g/mol}$=0.4mol,
(1)由方程式4Zn+10HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4Zn(NO3)2+N2O↑+5H2O可知生成0.1molN2O,体积为0.1mol×22.4L/mol=2.24L,
答:生成N2O气体体积是2.24升;
(2)反应中N元素化合价由+5价降低到+1价,生成0.1molN2O,有0.2mol硝酸被还原,
答:被还原的硝酸的物质的量是0.2mol.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量关系是解本题关键,注意转移电子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油里 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止氧化,FeSO4溶液存放在加有少量铜粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径从大到小的顺序是:M>Z>Y>X | |
| B. | 元素X、Z可形成某种化合物,其分子内既含极性键又含非极性键 | |
| C. | 化合物YO2、ZO2都能和氢氧化钠溶液反应,均属于酸性氧化物 | |
| D. | 金属M制品具有较强的抗腐蚀能力,说明M元素的金属活动性较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C=O | C-O | C-H | H-H | O-H |
| 键能/kJ•mol-1 | 745 | 351 | 415 | 436 | 462 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 起始时合金粉末的质量/mg | 204 | 399 | 561 |
| 反应结束时生成气体的体积/mL | 224 | 336 | 336 |
| A. | 起始时盐酸的浓度为1mol•L-1 | B. | 加入的NaOH溶液为40mL | ||
| C. | 合金中镁、铝的物质的量相等 | D. | 所得的滤液中含三种阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
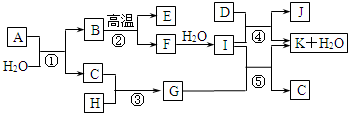
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com