
| A、0.6mol |
| B、0.95mol |
| C、1mol |
| D、1.5mol |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS溶于水:NaHS═Na++HS-;HS-+H2O?H3O++S2- |
| B、(NH4)2SO4溶于水:(NH4)2SO4?2NH4++SO42- |
| C、HF溶于水:HF+H2O?F-+2H++OH- |
| D、Al(OH)3的电离:Al(OH)3═Al3++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
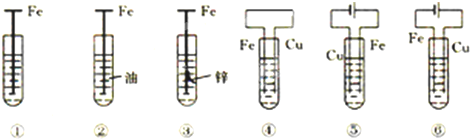
| A、①发生析氢腐蚀 |
| B、③是牺牲阳极的阴极保护法 |
| C、若将⑥的Cu极换成不溶性电极,则⑥是外加电流的阴极保护法 |
| D、腐蚀快到慢的顺序为⑤>④>①>②>③>⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、左池电极反应式:X4++2e-=X2+ |
| B、每消耗1mol Y2O72-,转移3mol电子 |
| C、左池中阴离子数目增加 |
| D、改变右池溶液的c(H+),电流强度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com