
分析 将钠投入溶液中,钠和水反应生成氢氧化钠和氢气,发现烧杯中有气泡产生为氢气,标况下13.44L氢气的物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,氢氧化钠和AlCl3和MgCl2发生复分解反应,2NaOH+MgCl2=2NaCl+Mg(OH)2↓、3NaOH+AlCl3=3NaCl+Al(OH)3↓,在这过程中还看到烧杯中有白色沉淀产生21.4g为Mg(OH)2、Al(OH)3,沉淀沉淀物先多后少是因为:NaOH+Al(OH)3=NaAlO2+2H2O,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,NaOH+Al(OH)3=NaAlO2+2H2O,否则剩余Al(OH)3会继续溶解生成NaAlO2,混合沉淀物21.4g中含有OH-全部来自NaOH,根据OH-守恒,发现得到21.4g沉淀时已有4molNaOH用于生成Al(OH)3以及将其溶解,根据4NaOH+AlCl3=NaAlO2+2H2O+3NaCl求解,据此分析解答.
解答 解:标况下13.44L氢气的物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{13.44L}{22.4L/mol}$=0.6mol,2Na+2H2O=2NaOH+H2↑同时产生1.2molNaOH,氢氧化钠和AlCl3和MgCl2发生复分解反应:2NaOH+MgCl2=2NaCl+Mg(OH)2↓、3NaOH+AlCl3=3NaCl+Al(OH)3根据题义,沉淀先多后少,所以可以判断剩余沉淀为Mg(OH)2和Al(OH)3的混合物,因将21.4g沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,所以溶液中没有NaOH,沉淀减少为NaOH+Al(OH)3=NaAlO2+2H2O,剩余沉淀:21.4-15.6=5.8g是Mg(OH)2,其物质的量为:n=$\frac{m}{M}$=$\frac{5.8g}{58g/mol}$=0.1mol,2NaOH+MgCl2=2NaCl+Mg(OH)2↓,所以初始溶液中MgCl2也有0.1mol,MgCl2浓度为c=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/L;
将21.4g沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,沉淀减少的量就是沉淀中含有的Al(OH)3的量:n=$\frac{m}{M}$=$\frac{15.6g}{78g/mol}$=0.2mol,
Mg(OH)2和Al(OH)3的混合沉淀物21.4g中含有OH-全部来自NaOH,0.1molMgCl2形成沉淀需OH-0.2mol,0.2molAl(OH)3需OH-0,6mol,所以得到21.4g沉淀时已有1.2-0.8=0.4molNaOH用于生成Al(OH)3以及将其溶解,根据4NaOH+AlCl3=NaAlO2+2H2O+3NaCl,所以参加这部分反应的AlCl3的物质的量为:$\frac{0.4mol}{4}$=0.1mol,所以初始溶液中有AlCl3的物质的量为:0.1mol+0.2mol=0.3mol,AlCl3的物质的量浓度为c=$\frac{n}{V}$=$\frac{0.3mol}{0.1L}$=3mol/L;
初始溶液中MgCl20.1mol,AlCl30.3mol,所以原混合溶液中Cl-的物质的量为:0.1mol×2+0.3mol×3=1.1mol,其物质的量浓度为c=$\frac{n}{V}$=$\frac{1.1mol}{0.1L}$=11mol/L;
故答案为:Mg2+的物质的量浓度1mol/L;Al3+的物质的量浓度3mol/L;Cl-的物质的量浓度11mol/L.
点评 本题考查混合物的有关计算,侧重对学生思维能力的考查,掌握镁、铝及其化合物的性质是解答的关键,注意4NaOH+AlCl3=NaAlO2+2H2O+3NaCl,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅含有碳元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
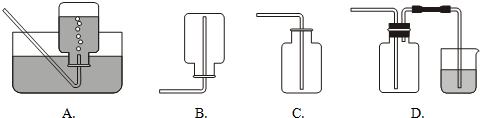
| 气体 | 所含杂质气体 | 除杂所用试剂 | 收集气体方法(已去除杂质) |
| 氨气 | 水蒸气 | a | B |
| 一氧化氮 | 二氧化氮 | b | A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液 Al+2OH-→AlO2-+H2↑ | |
| B. | 铁跟稀硫酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
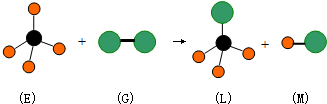
| A. | L能溶于水 | B. | M属于离子化合物 | ||
| C. | G有漂白性 | D. | 该反应是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 乙烷(已烯):加溴水,分液 | |
| C. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com