
| A. | 六方最密堆积和面心立方最密堆积的原子堆积方式,空间利用率最高 | |
| B. | 分子晶体中,分子间作用力越大,分子越稳定 | |
| C. | 熔点:BaO>CaO>NaCl>KCl | |
| D. |  某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子个数之比是1:2:1 |
分析 A、金属的四种堆积形式与空间利用率的关系;
B、物质的稳定性与化学键有关,属于化学性质,与分子间作用力无关;
C、离子晶体中,电荷越大,离子半径越小,则晶体的熔沸点越大;
D、晶体的部分结构为正三棱柱,根据分摊法知顶角有$\frac{1}{12}$的A属于该晶胞,侧棱上的B有$\frac{1}{6}$属于该晶胞,位于上下底面边上的B有$\frac{1}{4}$属于该晶胞,含C原子个数为1,则A、B、C三种原子个数可求出,原子个数之比便可求出.
解答 解:A、金属的四种堆积分别为简单立方堆积、体心立方堆积、面心立方最密堆积和六方最密堆积,其中简单立方堆积利用率最低,其次体心立方堆积,六方最密堆积和面心立方最密堆积空间利用率最高,故A正确;
B、物质的稳定性与化学键有关,属于化学性质,与分子间作用力无关,故B错误;
C、均为离子晶体,CaO、BaO的电荷高,钙离子半径小于钡离子半径,钠离子半径小于钾离子半径,则熔沸点:CaO>BaO>NaCl>KCl,故C错误;
D、A位于正三棱柱的顶角,则有$\frac{1}{12}$的A属于该晶胞,该晶胞中含A的个数为6×$\frac{1}{12}$=$\frac{1}{2}$,B分为两类,位于侧棱上的B有$\frac{1}{6}$属于该晶胞,位于上下底面边上的B有$\frac{1}{4}$属于该晶胞,该晶胞含B原子个数为3×$\frac{1}{6}$+6×$\frac{1}{4}$=2,含C原子个数为1,则A、B、C三种原子个数之比为$\frac{1}{2}$:2:1=1:4:2,故D错误.
故选A.
点评 本题考查晶体类型及结构,为高频考点,把握晶体类型、熔沸点比较方法、稳定性比较方法、均摊法的应用等为解答该题的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}{O}_{2}$、${\;}_{\;}^{18}{O}_{2}$互为同位素 | B. | H2O、D2O、T2O的化学性质不同 | ||
| C. | 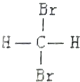 和 和 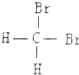 是两种不同结构 是两种不同结构 | D. | 白磷与红磷互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
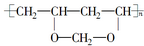 ,它是由聚乙烯醇
,它是由聚乙烯醇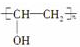 与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )| A. | CH3OH | B. | HCHO | C. | HO-CH2CH2-OH | D. | HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
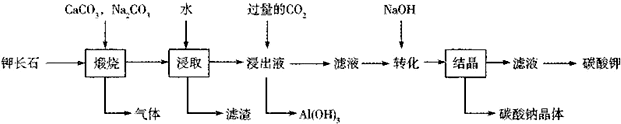
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
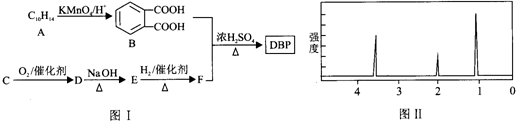
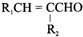 +H2O(R1、R2示氢原子或烃基)
+H2O(R1、R2示氢原子或烃基) .
.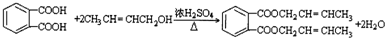 .
.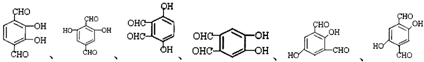 任意2种(填结构简式).
任意2种(填结构简式).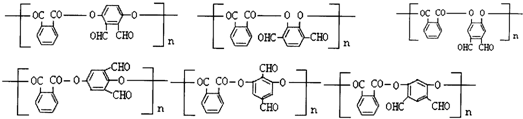 任意一种(填结构简式).
任意一种(填结构简式).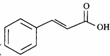 ) 的合成路线
) 的合成路线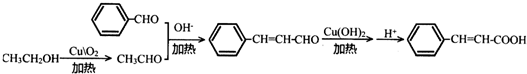 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com