
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:①单位时间内生成n mol H2的同时生成2n mol HI时,反应未达到平衡状态,故错误;
②反应过程中有一个H-H键断裂的同时有两个H-I键断裂,说明正逆反应速率相等,证明反应达到平衡状态,故正确;
③各组分多少,与开始加入的物质的量多少有关,与平衡无关,故错误;
④无论反应是否达到平衡状态,反应速率之比都等于其化学计量数之比,所以v(H2)=V(I2)=$\frac{1}{2}$v(HI)不能说明反应达到平衡状态,故错误;
故答案为:②.
点评 本题考查了化学平衡状态的判断,难度不大,注意平衡是各组分浓度不变,正逆反应速率相等是平衡的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯 | B. | 乙基(-CH2CH3) | C. | 碳正离子[(CH3)3C+] | D. | 碳烯(:CH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极、电解池的阳极均发生氧化反应 | |
| B. | 原电池将化学能转化为电能,电解池将电能转化为化学能 | |
| C. | 电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 | |
| D. | 利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.| C | D | |
| G |
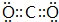 .
.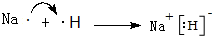 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com