
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
科目:高中化学 来源: 题型:
【题目】(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/(mol·L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①前20min的平均速率ν(H2)为__________,该温度下此反应化学平衡平衡常数为_________。
②能提高反应中N2的平衡转化率的是___________。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
该反应的化学方程是_________________________________;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应__________达到平衡状态(填是或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
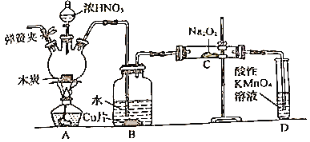
已知:
室温下,①2NO+Na2O2===2NaNO2
②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是________________________________________。
(2)装置B中观察到的主要现象为________________________________________,发生反应离子方程式是_____________。
(3)装置D的作用是______________________________,发生反应的离子方程式是________________________________________。
(4)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和__________(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为__________(写名称)。
(5)利用改进后的装置将3.12gNa2O2完全转化为NaNO2,理论上至少需要木炭__________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是____,当1 mol O2发生反应时,还原剂所失电子的物质的量为_____mol, 其中被S 元素还原的O2的物质的的量为__________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
2HI(g) H<0,若在恒容绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A. 混合气体的密度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开1mol H-H键的同时生成2mol H-I键
D. 容器内气体的浓度c(H2)∶c(I2)∶c(HI) = 1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
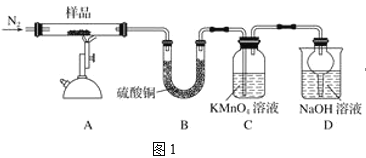
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水。
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在气体______。
(4)实验中要持续通入氮气,否则测出的x会_____(填“偏大”、“偏小”或“不变”)。
(5)从理论上分析得出硫酸亚铁分解还生成另一物质三氧化硫,写出硫酸亚铁分解的化学方程式________。
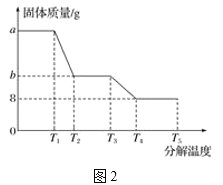
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量分解温度的关系如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )
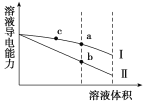
A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月3日我国确诊首例非洲猪瘟疫情。10月25日,农业农村部新闻办公室发布,贵州省毕节市发生非洲猪瘟疫情。目前最有效的药物要主要成分的一种合成路线如图所示:
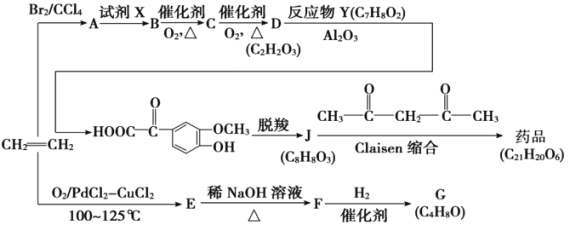
已知:
①E、G能发生银镜反应
②R—CHO+R′—CH2—CHO ![]()
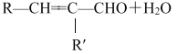 (R、R表示烃基或氢)。
(R、R表示烃基或氢)。
请回答下列问题:
(1)G的名称是____________________;D中所含官能团的名称是____________________。
(2)Y的结构简式为__________________;A生成B的反应类型是__________________。
(3)据最新报道,乙烯与双氧水在催化剂作用下反应生成B,产率较高。写出该反应的化学方程式____________________________________________。
(4)简述逐一检测出F中官能团的实验操作与现象结论______________________。
(5)在J的同分异构体中,同时满足下列条件的同分异构体有___________种。
i.既能发生水解反应,又能发生银镜反应;
ii.遇氯化铁溶液发生显色反应。
(6)参照上述流程,以苯乙烯为原料,设计路线制备某药物中间体
 _________________________________。
_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用固体烧碱配制480mL 0.1 mol·L-1的NaOH溶液,请回答以下问题:
(1)需称量_______g烧碱固体,它应盛在_____中进行称量。
(2)配制过程中,不需要使用的仪器是(填序号)_____________。
A、托盘天平 B、药匙 C、烧杯 D、胶头滴管 E、玻璃棒 F、1000mL容量瓶 G、500mL容量瓶
(3)若配制0.1 mol·L-1的NaOH溶液的其他操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏高的是___________(填序号)。
A.将NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的NaOH溶液向容量瓶中转移时,因操作不当使部分溅出瓶外
C.定容摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
D.定容时俯视容量瓶的刻度线
Ⅱ.欲用98% 的浓硫酸(ρ=1.84 g·cm-3 )配制成浓度为0.5 mol·L-1 的稀硫酸480mL。
(1)所需浓硫酸的体积为___mL。
(2)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(3)操作正确的顺序为_____(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度
D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com