
| A. | 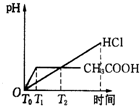 | B. | 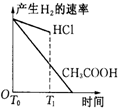 | C. | 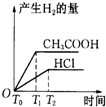 | D. | 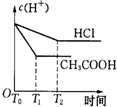 |
分析 n(Zn)=$\frac{0.65g}{65g/mol}$=0.01mol,n(HCl)=0.1mol/L×0.1L=0.01mol,CH3COOH是弱电解质,醋酸浓度大于盐酸,所以等pH、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.01mol,酸和Zn反应离子方程式为Zn+2 H+=Zn2++H2↑,
根据方程式知,锌剩余0.005mol,CH3COOH溶液中存在电离平衡,平衡状态下的H+不足,但随着反应进行,CH3COOH又电离出H+进行反应,放出的氢气一定比HCl多,开始时由于c(H+)相同,开始的反应速率相同,反应过程中CH3COOH溶液中的c(H+)始终比HCl溶液中的c(H+)大,所以反应速率快;反应后,CH3COOH有剩余,导致CH3COOH溶液中pH小于盐酸溶液中,据此分析解答.
解答 解:n(Zn)=$\frac{0.65g}{65g/mol}$=0.01mol,n(HCl)=0.1mol/L×0.1L=0.01mol,CH3COOH是弱电解质,醋酸浓度大于盐酸,所以等pH、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.01mol,酸和Zn反应离子方程式为Zn+2 H+=Zn2++H2↑,
根据方程式知,锌剩余0.005mol,CH3COOH溶液中存在电离平衡,平衡状态下的H+不足,但随着反应进行,CH3COOH又电离出H+进行反应,放出的氢气一定比HCl多,开始时由于c(H+)相同,开始的反应速率相同,反应过程中CH3COOH溶液中的c(H+)始终比HCl溶液中的c(H+)大,所以反应速率快;反应后,CH3COOH有剩余,导致CH3COOH溶液pH小于盐酸溶液,
A.通过以上分析知,开始时,二者溶液中pH相等,随着反应的进行,醋酸电离出部分氢离子,且最终反应后产生有剩余,所以醋酸pH>HCl,当HCl完全反应后,溶液中pH不变,故A错误;
B.反应速率与c(H+)成正比,开始时c(H+)相等所以其反应速率相等,但随着反应进行,HCl中c(H+)小于CH3COOH,所以反应速率CH3COOH>HCl,故B错误;
C.等pH、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.01mol,与足量锌反应时,生成氢气的量取决于酸的物质的量,所以生成氢气的量CH3COOH>HCl,反应速率与离子浓度成正比,反应过程中c(H+)CH3COOH>HCl,所以醋酸反应时间短,故C正确;
D.CH3COOH是弱电解质、HCl是强电解质,随着反应的进行,CH3COOH继续电离,所以反应过程中(H+)CH3COOH>HCl,但都是减小的,当酸完全反应后,(H+)不变,反应速率与离子浓度成正比,反应过程中c(H+):CH3COOH>HCl,所以醋酸反应时间短,故D错误;
故选C.
点评 本题考查弱电解质的电离,侧重考查分析、推断能力,明确弱电解质电离特点是解本题关键,注意反应速率与离子浓度有关,与电解质强弱无关,金属足量时产生气体的量与酸的量有关,与酸的强弱无关,这些都是易错点.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2R是二元弱酸,其Kal=1×10-2 | |
| B. | 当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-) | |
| C. | NaHR在溶液中水解倾向大于电离倾向 | |
| D. | 含Na2R与NaHR各0.1mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7×10-3 mol/L | B. | 1.9×10-4mol/L | C. | 1.7×10-4mol/L | D. | 5.7×10-5mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-H之间只是sp2形成的σ键,C-C之间只是未参加杂化的2p轨道形成的π键 | |
| B. | C-C间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| D. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com