
����Ŀ��25��ʱ����0.1mol��L-1HCl��Һ�ζ�20��00mL 0.1mol��L-1BOH��Һ���õĵζ�������ͼ������˵����ȷ����
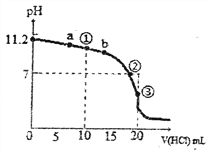
A. BOHΪһԪ����ζ������ʱ����һԪ����ĵ���ƽ�ⳣ��KbԼΪ10-5.6
B. �μ�����Ĺ����У�����Һ��c(BOH)=c(B+)ʱ�����ܳ�����b��
C. �μ�����Ĺ�����ˮ�ĵ���̶��������ڢڵ�ʱ�ﵽ�������С
D. �����ʾ��Һ�У�c(B+)+c(H+)>c(BOH)+c(OH-)
���𰸡�D
��������A. 0.1mol��L-1BOH��Һ��pHΪ11.2��˵��BOHδ��ȫ���룬ΪһԪ���0.1mol��L-1BOH��Һ��pHΪ11.2����Kb=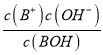 =
=![]() =10-4.6����A����B. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(BOH)��c(B+)����˵���Һ��c(BOH)=c(B+)ʱ�����ܳ�����a�㣬�����ܳ�����b�㣬��B����C. �μ�����Ĺ����У���Һ�ļ�����С����ˮ��������Ƴ̶���С��ˮ�ĵ���̶���������Һ�ﵽ��ʱ�����ɵ���ˮ�⣬�ٽ�ˮ�ĵ��룬ˮ�ĵ���ﵽ���Ȼ������������ˮ�ĵ��룬ˮ�ĵ�������С����C����D. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(Cl-)��c(B+) ��c(BOH)��c(Cl-)�����ݵ���غ�c(B+)+c(H+)= c(Cl-)+c(OH-)>c(BOH)+c(OH-)����D��ȷ����ѡD��
=10-4.6����A����B. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(BOH)��c(B+)����˵���Һ��c(BOH)=c(B+)ʱ�����ܳ�����a�㣬�����ܳ�����b�㣬��B����C. �μ�����Ĺ����У���Һ�ļ�����С����ˮ��������Ƴ̶���С��ˮ�ĵ���̶���������Һ�ﵽ��ʱ�����ɵ���ˮ�⣬�ٽ�ˮ�ĵ��룬ˮ�ĵ���ﵽ���Ȼ������������ˮ�ĵ��룬ˮ�ĵ�������С����C����D. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(Cl-)��c(B+) ��c(BOH)��c(Cl-)�����ݵ���غ�c(B+)+c(H+)= c(Cl-)+c(OH-)>c(BOH)+c(OH-)����D��ȷ����ѡD��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȡ����Ӧ����
A.��ϩ�ڿ�����ȼ��B.�����ڿ�����ȼ��
C.��ϩʹ��ˮ��ɫD.�����������ڹ�������ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӽ������ۼ�������˵������ȷ����(����)
A.CaCl2�м������Ӽ����й��ۼ�
B.�Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ���(��Cl2)��
C.�ڹ��ۻ���������ڣ�һ�����������Ӽ�
D.�ɶ���Ԫ����ɵĶ�ԭ�ӷ����һ��ֻ���ڼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Mn+�ĺ����x�����ӣ�������y�����ӣ���M��������Ϊ�� ��
A.y��x��n
B.y+x+n
C.y+x��n
D.y��x+n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������õõ���̼����ѭ���ĸ�Ҫý�顣��ͼ������ģ�������ù��̣���CO2��H2Oת��Ϊ����ͬʱ�ͷ�O2��װ�á�����˵����ȷ����
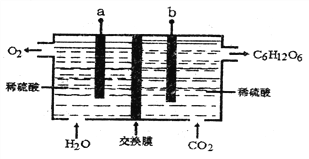
A. ��װ��Ϊԭ��أ�����a��ԭ��ص�����
B. �ý���ĤΪ�����ӽ���Ĥ��H+����Ĥ���������ƶ�
C. ����������������ģ������·ͨ��1mole-ʱ����15g������
D. b�������ĵ缫��Ӧ��6CO2+24e-+18H2O=C6H12O6+24OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ���������ҵ�����ù㷺��
��1�����������ŷ����γɳ�����ն���Ҫ����֮һ�����������ƻ�������ԭ��Ϊ��i. NO+O3![]() NO2+O2 K1 ii. NO2+O
NO2+O2 K1 ii. NO2+O![]() NO+O2 K2
NO+O2 K2
��ӦO3+O![]() 2O2 ��ƽ�ⳣ��K=_____����K1��K2��ʾ����NO�ڸ÷�Ӧ�����е�������_______��
2O2 ��ƽ�ⳣ��K=_____����K1��K2��ʾ����NO�ڸ÷�Ӧ�����е�������_______��
��2��N2H4�ǻ���������ȼ����N2H4�백�����ƣ�����ˮ��������N2H4��H2O��д��N2H4��H2O�ĵ��뷽��ʽ___________��
��3����֪t ��ʱ��KW��1��10��13����t ��_______25��(������������������������)����t ��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4��Һb L���(���Ի�Ϻ���Һ����ı仯)�������û����Һ��pH��2����a��b��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܸ߷��Ӳ���M( ![]() )���л�ѧ��Ӧ���ԡ������ԡ����������Ե��ص㡣�����Ǻϳ�M�����̣�
)���л�ѧ��Ӧ���ԡ������ԡ����������Ե��ص㡣�����Ǻϳ�M�����̣�
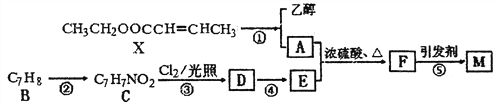
��1������C������Ϊ____________������M�ķ���ʽΪ______________��
��2��д����Ӧ�ٵĻ�ѧ����ʽ______________________________________��
��3����Ӧ�ܵķ�Ӧ������__________��Ӧ��������5����Ӧ������ȡ����Ӧ����_____����
��4���л���N�ķ���ʽΪC5H8O2�����л�����ڶ���ͬ���칹�壬����ͬʱ����������������_____�֡�
�����л���X��Ϊͬϵ���̼̼˫���������ǻ����ȶ��������Ǵ��഼�γ����Ľṹ��
��5����֪��![]()
���һ�����Ҵ�Ϊԭ���Ʊ��л���X�ĺϳ�·��(���Լ���ѡ)��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪ W ��һ�ֺ��ص�������Ϊ 18��������Ϊ 10��X �� Ne �ĺ����������� 1�� ��Z���ڵ������У�Z Ԫ�ص�ԭ�ӵõ���������ǿ������Ԫ�ص�����������֮��Ϊ18�� ��ش��������⣺
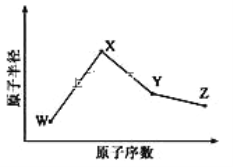
��1��X Ԫ��λ��Ԫ�����ڱ���λ��Ϊ_____________��
��2��X �ĵ��ʺ� Y �ĵ���������۵�ϸߵ���____________��д��ѧʽ�� �� Z ������ļ��⻯�������е���ߵ���________(д��ѧʽ)��ԭ��Ϊ_________________________��
��3��W��X��Z ����Ԫ���γɵĻ������л�ѧ������Ϊ________��X2W2�ĵ���ʽΪ___________________��
��4��Y �� Z �� �ɵĻ������ڳ�������һ��Һ̬����������ˮ��Ӧ������һ�������һ��ǿ�ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
��5��Z ��������ܶ�������һ�ֻ���ɫ���� M����������Ϊ 47.41����������ˮ������ M ��Һ̬��Ũ����̬ʱ���б�ը�� �� M �Ļ�ѧʽΪ_____________�� M ���� NaOH ��Һ��Ӧ���������ȶ����������ǵ����ʵ���֮��Ϊ 1�U5���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��6���� 25��C��101kPa ������֪ Y �ļ���̬�⻯������������ȫȼ�պ�ָ���ԭ״̬�� ƽ��ÿת�� 1mol ���ӷ��� 190kJ, �÷�Ӧ���Ȼ�ѧ����ʽΪ__________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com