
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积___________。
(2)反应生成的MnCl2的质量为___________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A. Na与水反应时增大水的用量
B. 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C. 在H2SO4与NaOH两溶液反应时,增大压强
D. 恒温、恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的 ZrO3固体,它在高温下能传导O2。下列说法正确的是
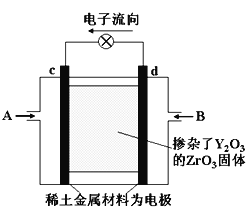
A.c电极名称为负极,气体A为空气
B.d电极上发生反应:CH4-8e-+4O2-=CO2+2H2O
C.O2向c电极移动
D.电池工作时,电子流动方向:d电极 → c电极 → d电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,反应N2(g)+3 H2(g) ![]() 2 NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为
2 NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol/L。若将容器的容积压缩为原来的
,N2与NH3的浓度均为c mol/L。若将容器的容积压缩为原来的![]() ,当达到新平衡时,下列说法中正确的是( )
,当达到新平衡时,下列说法中正确的是( )
A.新的平衡体系中,N2的浓度小于2 c mol/L大于c mol/L
B.新的平衡体系中,NH3的浓度小于2 c mol/L大于c mol/L
C.新的平衡体系中,混合气体的平均摩尔质量小于![]()
D.新的平衡体系中,气体的密度是原平衡体系的1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
MnCl2+Cl2↑+2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
(2)把___________ g NaOH固体溶解在90 g H2O中,才能使每10个水分子中含有1个Na+,这时所得溶液中NaOH的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第二次世界大战中拯救了成千上万士兵的生命,被誉为与原子弹、雷达齐名的当时三大发明之一的药物是( )
A.青霉素 B.阿司匹林 C.麻黄碱 D.抗酸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 5mol/L NaOH溶液加水稀释到500ml,稀释后溶液中NaOH的物质的量为
A.0.25mol B.2.5mol C.0.15mol D.1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA (g) +nB (g) ==C (g) +gD (g);△H <0,下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m: n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com