
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
分析 A.标准状况,水为液体;
B.OH-所含电子数等于质子数+电荷数;
C.体积与温度、压强有关;
D.溶液具有均一性.
解答 解:A.标准状况,水为液体,不能利用Vm计算其体积,故A错误;
B.OH-所含电子数为8+1+1=10,故B正确;
C.体积与温度、压强有关,则Vm不一定相等,等物质的量时体积可能不同,故C错误;
D.溶液具有均一性,则从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.5mol•L-1,故D错误;
故选B.
点评 本题考查物质的量的计算,为高频考点,把握体积、物质的量、浓度的关系为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ae | B. | aef | C. | abc | D. | ac |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH3溶于水显碱性 | 用氨气作“喷泉实验” |
| B | 高锰酸钾具有强氧化性 | 高锰酸钾须与活性金属粉末分开储存 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | 碘在酒精中溶解度大于在水中溶解度 | 用酒精萃取碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
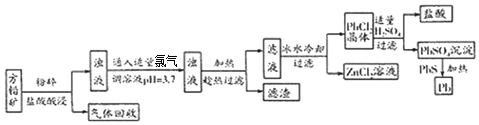
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
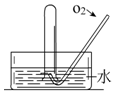 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LHA溶液的pH=3.5 | |
| B. | 0.1mol/LHA溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 0.1mol/LNaA溶液中,各离子浓度大小顺序为:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 向0.1mol/LNaA溶液中加水稀释,所有离子浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com