
【题目】乙烯可用作合成纤维、合成橡胶、合成塑料的原料。回答下列问题:
(1)实验室用乙醇和五氧化二磷制取乙烯的过程如下:
P2O5+3H2O=2H3PO4
H3PO4+C2H5OH→C2H5OPO(OH)2(磷酸单乙醋)+H2O;
170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。
C2H5OPO(OH)2分解反应的化学方程式为。
(2)向2 L的恒容密闭容器中充入0.1mol C2H6和0.1 molCO2 , 发生的反应为
C2H6 (g)+CO2(g) ![]() C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。
C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。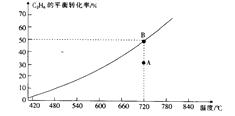
①在相应温度下,A点的反应速率v(正)(填“>”“<”或“=”)v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有 (任写一种)。
③720℃时,上述反应的平衡常数K=。
(3)用CrO3作催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g) ![]() C2H4(g)+H2(g) △H1 ;
C2H4(g)+H2(g) △H1 ;
3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) △H2 ;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) △H3。
①反应:C2H6(g)+CO2(g) ![]() C2H4(g)+ CO2(g) +H2O(g)的△H=(用含△H1、△H2、△H3的代数式表示)。
C2H4(g)+ CO2(g) +H2O(g)的△H=(用含△H1、△H2、△H3的代数式表示)。
②已知部分化学键的键能数据如下表所示,则△H1=kJ·mol-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ mol-1 | 348 | 615 | 413 | 436 |
【答案】
(1)C2H5OPO(OH)2![]() CH2=CH2↑+H3PO4
CH2=CH2↑+H3PO4
(2)>,适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案),0.025
(3)![]() ,+123
,+123
【解析】本题主要考查化学平衡的移动。
(1)170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。C2H5OPO(OH)2分解反应的化学方程式为C2H5OPO(OH)2 ![]() CH2=CH2↑+H3PO4。
CH2=CH2↑+H3PO4。
(2)①在相应温度下,A→B平衡向正反应方向建立,所以A点的反应速率v(正)>v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案)。
③720℃时,各物质的平衡浓度为:c(C2H6)=c(CO2)=c(C2H4)=c(CO)=c(H2O)=0.025mol/L,上述反应的平衡常数K= ![]() =0.025。
=0.025。
(3)①将上述热化学方程式分别用a、b、c表示,(3a+b+c)/3得:C2H6(g)+CO2(g) ![]() C2H4(g)+CO2(g)+H2O(g) △H=
C2H4(g)+CO2(g)+H2O(g) △H= ![]() 。
。
②△H=反应物键能之和-生成物键能之和,△H1=(615+6×413-348-4×413-436)kJ·mol-1=+123kJ·mol-1。
【考点精析】关于本题考查的化学平衡移动原理以及影响因素和化学平衡状态的判断,需要了解影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F六种元素的原子序数依次递增.己知: ①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,另外五种元素均为短周期主族元素;②A,C原子p轨道的电子数分别为2和4;③D原子最外层电子数为偶数;④E原子价电子(外围电子)排布为msnmpn﹣1 . 请回答下列问题:
(1)下列叙述正确的是(填序号).
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.六种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为(填元素符号).
(3)A与C形成的非极性分子,该分子与过量强碱反应生成的酸根离子的空间构型为 .
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,N 3﹣中心原子的杂化轨道类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A 的结构简式如图,下列有关 A 的性质叙述中,错误的是( ) 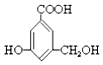
A.A 与金属钠完全反应时,两者物质的量之比为 1:3
B.A 与氢氧化钠完全反应时,两者物质的量之比为 1:1
C.A 能与碳酸钠溶液反应
D.A 既能与羧酸反应,又能与醇反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是
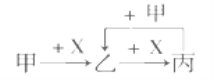
A. 甲为C,X是O2 B. 甲为CO2,X是NaOH溶液
C. 甲为Cl2,X为Fe D. 甲为Al,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1)NH2OH的电子式为。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl ![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺: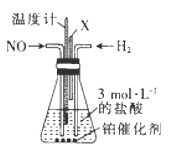
①该实验适宜的加热方式为。
②装置中导管X的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是( )
A.A的离子结构示意图为 ![]()
B.D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C.E和D形成的离子化合物ED2的电子式为 ![]()
D.B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )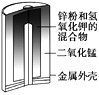
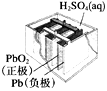
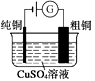
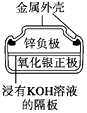
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A.图1所示电池中,MnO2的作用是催化剂
B.图2所示电池放电过程中,硫酸浓度不断增大
C.图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、现有100mL含Cu2+、Al3+、NH4+、H+、Cl-的溶液,向该溶液中逐滴加入2.5mol/LNaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:

(1)B点的沉淀物的化学式为______________。
(2)原溶液中Cu2+的物质的量为______,原溶液中Cl-物质的量浓度为________,x-y=__________。
Ⅱ、A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
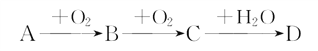
(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为___________。
(2)若A为单质,D为强碱且组成元素的原子所含质子的数目小于18,写出C→D的化学方程式:_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为中符合安全要求的是
A. 进入煤矿使用火把照明
B. 节日期间,在开阔的广场燃放烟花爆竹
C. 用点燃的火柴在液化汽钢瓶口检验是否漏气
D. 实验时,将水倒入浓硫酸配制稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com