
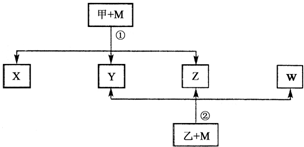
分析 从海水中提取溴的方法之一是:①氯气是氧化剂,可以氧化溴离子为溴单质;②用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,NaBr化合价降低1,生成NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒书写;③生成溴化钠和溴酸钠,在酸溶液中会反应归中反应;④氯气是氧化剂,可以氧化溴离子为溴单质,自身被还原成氯离子,据此分析解答.
解答 解:从海水中提取溴:①海水提取食盐后的母液中含有溴离子,通入氯气是氧化剂,可以氧化溴离子为溴单质,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
②用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
③溴离子和溴酸根离子在酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,
④得到的溴中可能夹杂着氯气,再加入FeBr2除去,溴离子被氯气氧化为溴单质,氯气被还原成氯离子,反应的方程式为:6FeBr2+3Cl2=2FeCl3+4FeBr3,
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;6FeBr2+3Cl2=2FeCl3+4FeBr3.
点评 本题考查了海水提溴的生产工艺流程分析判断,物质性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气是具有热值高、无污染等优点的燃料 | |
| B. | “可燃冰”是将水变为油的新型燃料 | |
| C. | 乙醇是比汽油更环保、不可再生的燃料 | |
| D. | 石油和煤是工厂经常使用的可再生的化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36L | B. | 1.12L | C. | 2.24L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 由2 mol H原子形成1 mol H-H键要吸收热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com