
���г����µ�������Һ�����±�����
|
|
�� |
�� |
�� |
�� |
�� |
|
��Һ |
��ˮ |
�������� |
���� |
���� |
������ |
|
pH |
11 |
11 |
3 |
3 |
8��3 |
�����й���������ȷ����
A��������Һ�У�ˮ�������c(OH-)��С���Ǣ�
B�����١���������Һ�������ϣ�������Һ�У�c(Cl��) ��c(NH4+)��c(H+)��c(OH-)
C���ֱ١��ڡ��ۡ��ܼ�ˮϡ��100����ϡ�ͺ�������Һ��pH���٣��ڣ��ۣ���
D���ڢ��м��������Ģ�����Һ�����ԣ�������Һ�У�c(Na+)��c(Cl��)��c(CH3COOH)
D
��������
���������A������ᡢ������ˮ�ĵ��룬�����ˮ����δٽ�ˮ�ĵ��룬������Һ�У�ˮ�������c(OH-)�����Ǣݣ�����B��һˮ�ϰ�Ϊ������١���������Һ�������ϣ���ˮԶ������������Һ�ʼ��ԣ�����C����ˮϡ�ͣ��ٽ�������ʵĵ��룬�ֱ١��ڡ��ۡ��ܼ�ˮϡ��100����ϡ�ͺ�������Һ��pHӦΪ���٣��ڣ��ܣ��ۣ�����D���ڢ��м��������Ģ�����Һ�����ԣ�������ҺΪ�Ȼ��ơ������ƺʹ���Ļ��Һ����Һ�У�c(Na+)��c(Cl��)��c(CH3COOH)����ȷ��
���㣺����������Һ���漰������ʵĵ��������ˮ���Ӧ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| ���¸�ѹ |
| ���� |
| ���¸�ѹ |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1��A��NH3 B��SO3 C��Cl2 D��BaSO4 E���ƾ� F��CH3COONH4
��1��A��NH3 B��SO3 C��Cl2 D��BaSO4 E���ƾ� F��CH3COONH4�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | HA���ʵ���Ũ�ȣ�mol/L�� | NaOH���ʵ���Ũ�ȣ�mol/L�� | �����Һ��pH |
| �� | 0.20 | 0.20 | pH=a |
| �� | 0.10 | 0.10 | pH=8.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ||
| ||
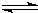 NH4++OH-
NH4++OH-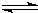 NH4++OH-
NH4++OH-�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com