
| A. | VL该气体的质量(以g为单位) | B. | 1L该气体中所含的分子数 | ||
| C. | 1mol该气体的体积(以L为单位) | D. | 1L该气体的质量(以g为单位) |
分析 在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则气体的物质的量为$\frac{X}{{N}_{A}}$,质量为$\frac{MX}{{N}_{A}}$,则$\frac{MX}{VNA}$=ρ,以此来解答.
解答 解:A.以g为单位VL该气体的质量为$\frac{X}{{N}_{A}}$mol×M g•mol-1,故A错误;
B.1L该气体所含的分子数为$\frac{X}{V}$,故B错误;
C.以L为单位,1mol该气体的体积为$\frac{V{N}_{A}}{X}$L,故C错误;
D.以g为单位1L该气体的质量即气体的密度为$\frac{X}{{N}_{A}}$mol×M g•mol-1÷VL=$\frac{MX}{VNA}$,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系等为解答的关键,侧重分析与应用能力的考查,注意计算公式中各量的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式为CnH2n | |
| B. | 可以使酸性高锰酸钾溶液褪色 | |
| C. | 在光照下可与氯气发生加成反应 | |
| D. | 随分子中碳原子数的增加,烷烃的熔沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | SO2使品红溶液褪色 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 6:1:1 | C. | 10:5:1 | D. | 15:5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
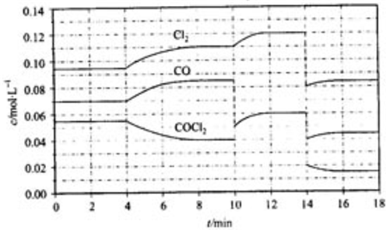
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
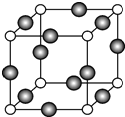 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com