
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 NH4+、 Mg2+、 Ba2+、 Cl-、 SO42—、 CO32—。
将该混合物溶于水后得澄清溶液。 现取3份100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
A | 加 AgNO3溶液 | 有白色沉淀生成 |
B | 加足量 NaOH 溶液并加热 | 收集到气体 1.12 L(标准状况下) |
C | 加足量 BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥称量 | 第一次称量沉淀质量为6.63 g,第二次称量沉淀质量为4.66 g |
试回答下列问题:
(1)根据实验A判断 Cl-是否存在_____(填“一定存在” 、 “一定不存在” 或“不能确定”)。
(2)该混合物中一定不存在的离子是_____。
(3)写出实验B发生反应的离子方程式_____________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
(5)混合物中是否存在 K+?_____(填“存在” 或“不存在” )
①如果存在, c(K+) _____mol/L(如果选择“不存在” ,此问不必做答)
②如果不存在,判断的理由是_____。(如果选择“存在” ,此问不必做答)
【答案】 不能确定 Ba2+、Mg2+ NH![]() +OH-NH3↑+H2O(无△扣1分,写成NH3·H2O不得分)
+OH-NH3↑+H2O(无△扣1分,写成NH3·H2O不得分)
阴离子符号 | 物质的量浓度(mol·L—1) |
SO | 0.2 |
CO | 0.1 |
存在 c(K+)≥0.1 mol/L
【解析】本题主要考查离子反应。
(1)根据实验A不能确定Cl-是否存在,因为氯化银、硫酸银、碳酸银都是白色沉淀。
(2)由实验C知该混合物中含有SO42-、CO32-,SO42-、CO32-与Ba2+发生反应,CO32-与Mg2+发生反应,所以一定不存在的离子是Ba2+、Mg2+。
(3)实验B发生反应的离子方程式:NH![]() +OH-=NH3↑+H2O。
+OH-=NH3↑+H2O。
(4)4.66g硫酸钡的物质的量为0.02mol,6.63g沉淀中含有碳酸钡6.63g-4.66g=1.97g,碳酸钡的物质的量为0.01mol,c(SO42-)=0.02mol/0.1L=0.2mol/L,c(CO32-)=0.01mol/0.1L=0.1mol/L。
阴离子符号 | 物质的量浓度(mol·L—1) |
SO | 0.2 |
CO | 0.1 |
(5)为了满足电荷守恒,混合物中一定存在K+。
①1.12L(标准状况下)氨的物质的量为0.05mol,c(NH![]() )=0.05mol/0.1L=0.5mol/L,电荷守恒:c(K+)+c(NH
)=0.05mol/0.1L=0.5mol/L,电荷守恒:c(K+)+c(NH![]() )=2c(SO42-)+2c(CO32-)+c(Cl-),Cl-不能确定是否存在,故c(K+)≥01 mol/L。
)=2c(SO42-)+2c(CO32-)+c(Cl-),Cl-不能确定是否存在,故c(K+)≥01 mol/L。


科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A. CH4 B. C2H5OH C. C2H4O D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 工业制漂白粉:Cl2+2OH-===Cl-+ClO-+H2O
B. 将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO-
C. 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇. 某化学兴趣小组对亚硝酸钠进行多角度探究:
i.亚硝酸钠的制备
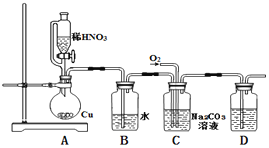
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____.
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______________。
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃
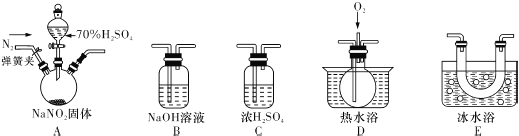
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________.
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、______、______、______.
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是_________________.
②装置B的作用是____________________.
iii. 设计实验证明酸性条件下NaNO2具有氧化性:___________。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. 澄清石灰水中通入过量的二氧化碳CO2+OH-===HCO![]()
B. 金属钠和水反应2Na+2H2O===2Na++2OH-+H2↑
C. 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2===2Fe3++O2↑+2H+
D. 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H2O===BaSO4↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不合理的是

A. 装置①:证明元素非金属性强弱 S>C>Si
B. 装置②:四氯化碳萃取碘水中的碘
C. 装置③:制备并收集少量NO气体
D. 装置④:制备少量氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如下图,下列对该实验的描述错误的是( )

A. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
B. 长玻璃管起冷凝回流作用
C. 不能用水浴加热
D. 加入过量乙酸可以提高1丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氯化铁腐蚀铜板:Fe3++Cu===Fe2++Cu2+
B. 实验室制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 稀硫酸中加氢氧化钡溶液至溶液呈中性:Ba2++H++OH-+SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
D. 用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2 ===SO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在盛有溴水的三支试管中分别加入酒精、四氯化碳和苯,振荡后静置,出现下列现象,正确的结论是( )

A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com