

分析 (1)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气,C装置是反应掉空气中的氧气;按照气体流向进行开关的操作;
(2)D中发生的反应一定是铜和浓硝酸的反应生成二氧化氮气体,同时可能硝酸变稀生成一氧化氮气体;
(3)根据装置的特点和压强关系进行分析判断;
(4)根据E中生成的硝酸溶液体积为100ml,结合化学方程式计算生成的一氧化氮气体,一氧化氮和氮气的体积之和与收集的气体体积比较判断.
解答 解:(1)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气,C装置是反应掉空气中的氧气,所以进入D装置的气体主要是氮气依据气体流向,开关操作是关闭K3,打开K1、K2,让氮气把试管中的空气赶净,更好的利用后续试验测定气体体积和验证一氧化氮气体的生成,
故答案为:N2;K3 ;K1、K2;
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜二氧化氮和水,可能发生的反应是浓硝酸变稀后和铜的反应生成硝酸铜一氧化氮和水,D中一定发生反应的离子方程式:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,
故答案为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;
(3)DEF在关闭K3后装置是一套气密性完好的装置,若E中出现倒吸,可以调节F中量气管的液体高度改变压强,向下调节量气管,使E中的压强减少,防止液体进入E发生倒吸,或直接关闭K3,不让液体进入E装置,
故答案为:向下调节量气管(或及时关闭K3);
(4)通过计算分析判断,E装置中生成的硝酸溶液体积为100ml,浓度为0.05mol/L,所以生成硝酸物质的量为0.005mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0025mol,在标准状况下的体积=0.0025mol×22.4L/mol=0.056L=56ml,加上原来试管中的氮气50ml,共计106ml,小于题干中实验测得的气体体积120ml.说明铜和浓硝酸反应的过程中生成二氧化氮气体同时也生成了一氧化氮气体,
故答案为:有;E装置中生成100mL、0.05 mol/L-1硝酸时产生的NO约为56 mL,而试管中原有50 mL N2,二者之和小于120mL,说明生成NO2的同时有NO生成.
点评 本题考查性质实验方案的设计,涉及硝酸的化学性质应用,量气管的正确使用方法,主要是分析装置中的气体流向和各装置的作用,装置图中的隐含条件气体体积的应用,酸碱反应的计算,题目较难,需要具备扎实的基础知识和实验基本操作技能.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 液480mL.
液480mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 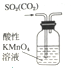 装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. | 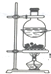 装置,分离NH4Cl和Ca(OH)2固体 | |
| D. | 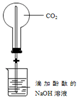 装置,做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Z2+2A2+═2A3++2Z-不能进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 氧化性由弱到强的顺序是XO${\;}_{4}^{-}$、Z2、B2、A3+ | |
| D. | 还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若将乙池电解液换成AgNO3溶液,则可以实现在石墨棒上镀银 | |
| B. | 甲池通入CH3OH的电极反应式为CH3OH+6e-+2H2O═CO$\stackrel{2-}{3}$+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗224mL(标准状况下)O2,此时丙池中理论上产生1.16g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
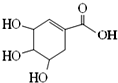
| A. | 分子式为C7H10O5 | |
| B. | 分子中含有3种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com