

分析 (1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘不容易溶于水,但碘离子易溶于水;
(2)分离互不相溶的液体采用分液的方法分离;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色.
解答 解:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘不容易溶于水,但碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子,
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘进入水层;
(2)四氯化碳属于有机物、水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,
故答案为:分液;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;
另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2 IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,
故答案为:从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I-,否则不含I-;
另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-.
点评 本题以物质的制备为载体考查了氧化还原反应、离子的检验、物质的分离和提纯,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
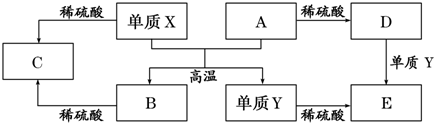
| A. | 单质Y在一定条件下能与水发生置换反应 | |
| B. | 向D溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | X与A反应的化学方程式是 Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能与酸反应所以均是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些金属、非金属元素化合时也能形成共价键 | |
| B. | 只有阴、阳离子间才能形成离子键 | |
| C. | 升温能加快钠与氧气反应生成氧化钠反应的速率 | |
| D. | FeCl2不能通过两种单质化合反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5 NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价等于它所处的主族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
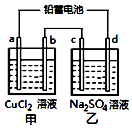 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com