
| A. | 全部 | B. | ②④⑤⑥ | C. | ②⑤ | D. | ④⑥ |
分析 氯气微溶于水,氯气与发生反应:Cl2+H2O═Cl-+H++HClO,自来水中含有Cl-、H+、ClO-、HClO、Cl2等粒子,根据粒子的性质解答该题.
解答 解:氯气微溶于水,氯气与发生反应:Cl2+H2O═Cl-+H++HClO,自来水中含有Cl-、H+、ClO-、HClO、Cl2等粒子,
①③与氢离子发生中和反应;
ClO-、HClO、Cl2等离子具有强氧化性,
其中②⑤⑥⑦与HClO、Cl2等粒子发生氧化还原反应而变质,
②AgNO3与Cl-反应产生AgCl沉淀而变质,
故选A.
点评 本题考查氯水的性质,为高频考点,侧重于双基的考查,题目难度不大,注意氯水的组成及成分粒子的化学性质,在配制溶液时要滤过变质问题.


科目:高中化学 来源: 题型:选择题
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 金属钛有可能在21世纪得到广泛运用 | |
| C. | 广泛运用铝合金,是因为铝不能与酸、碱、O2等反应 | |
| D. | 目前世界上用途最广的合金是钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
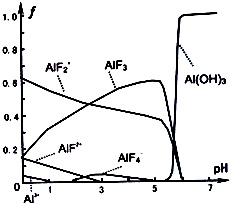
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
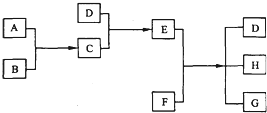
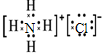
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,说明原溶液中一定含SO42- | |
| B. | 将含有SO2杂质的CO2气体,缓慢通过足量的高锰酸钾溶液,再通过浓硫酸干燥,可获得较纯净的CO2气体 | |
| C. | 某钠盐(含NaHCO3、Na2CO3中的一种或两种)试样0.168 g,将其灼烧,冷却,并用托盘天平称量残留固体的质量,根据质量是否变化,可确定样品的组成 | |
| D. | 铝热反应可生成铁,工业上可大量利用该反应来生产铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
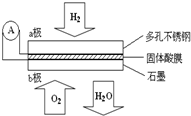 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法不正确的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由a极通过固体酸电解质传递到b极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 碳酸钙与醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| ② | 氢氧化钠溶液中通入CO2 | OH-+CO2=HCO3- | 错误,通往过量CO2应生成CO32- |
| ③ | NaHCO3的水解 | HCO3-+H2O?H2CO3+OH- | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 正确 |
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com